Höfundur:
John Pratt
Sköpunardag:
17 Febrúar 2021
Uppfærsludagsetning:
24 Júní 2024

Efni.
- Að stíga
- Aðferð 1 af 2: Útreikningur á molamassa frumefnis
- Aðferð 2 af 2: Útreikningur á molamassa samsetts efnis
- Ábendingar
- Viðvaranir
- Nauðsynjar
Atóm eru of lítil fyrir marktækar mælingar á efnum. Til þess að geta unnið með mjög lítið magn af tilteknu efni eru þau flokkuð af vísindamönnum í einingum mól. Mól er skilgreint sem ákveðið magn efnis með jafn margar agnir og fjöldi kolefnisatóna í 12 grömmum af samsætunni C-12, sem jafngildir u.þ.b. 6,022 14 × 10. Þetta er kallað Avogadro tala eða fasti. Það er notað til að gefa til kynna fjölda atóma, sameinda, jóna eða undirstofna agna í hvaða efni sem er, og massi 1 mól er molamassi þess efnis. Hér getur þú lesið hvernig á að reikna molamassa frumefna og efna.
Að stíga
Aðferð 1 af 2: Útreikningur á molamassa frumefnis
 Finndu hlutfallslegan atómmassa frumefnisins. Hlutfallslegur atómmassi frumefnis er vegið meðaltal, gefið upp í atómmassaeiningum (u), af lotumassa allra samsætna sem eru náttúrulega. Þessar upplýsingar er að finna í reglulegu töflu. Sem dæmi hefur vetni hlutfallslegan atómmassa 1,008; kolefni 12.0107; súrefni 15.9994; og klór 35.453.
Finndu hlutfallslegan atómmassa frumefnisins. Hlutfallslegur atómmassi frumefnis er vegið meðaltal, gefið upp í atómmassaeiningum (u), af lotumassa allra samsætna sem eru náttúrulega. Þessar upplýsingar er að finna í reglulegu töflu. Sem dæmi hefur vetni hlutfallslegan atómmassa 1,008; kolefni 12.0107; súrefni 15.9994; og klór 35.453. 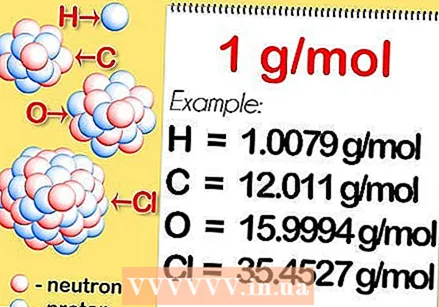 Margfaldaðu með molamassanum. Þetta er skilgreint sem 1 grömm á mól. Þetta breytir atómmassaeiningunni í grömm á hvert mól, þannig að mólmassi vetnis er 1.008 grömm á mól, kolefni 12.0107 grömm á mól, súrefni 15.9994 grömm á mól og klór 35.453 grömm á mól.
Margfaldaðu með molamassanum. Þetta er skilgreint sem 1 grömm á mól. Þetta breytir atómmassaeiningunni í grömm á hvert mól, þannig að mólmassi vetnis er 1.008 grömm á mól, kolefni 12.0107 grömm á mól, súrefni 15.9994 grömm á mól og klór 35.453 grömm á mól. - Finndu molamassa tvígilds sameindar. Sum frumefni er aðeins að finna í sameindum sem eru 2 eða fleiri. Þetta þýðir að ef þú vilt reikna mólmassa frumefnis sem til dæmis samanstendur af 2 atómum, svo sem vetni, súrefni og klór, ákvarðuðu hlutfallslegan atómmassa og margföldaðu hann með mólmassanum og margföldaðu niðurstaða um 2.
- Mólmassi frumefnis er þá jafnt og molamassi eins atóms sinnum fjöldi atóma í hverri sameind: þegar um er að ræða vetni, 1,008 sinnum 2, eða 2,016 grömm á mól; súrefni, 15.9994 sinnum 2, eða 31.9988 grömm á mól; og með klór, 35.453 sinnum 2, eða 70.096 grömm á mól.
Aðferð 2 af 2: Útreikningur á molamassa samsetts efnis
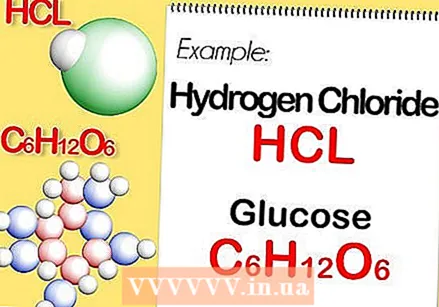 Ákveðið efnaformúlu efnasambandsins. Þetta er fjöldi frumeinda í hverju frumefni efnasambandsins. (Þú finnur upplýsingar um þetta í til dæmis Binas) Til dæmis: formúlan fyrir vetnisklóríð (saltsýra) er HCl; fyrir glúkósa C6H.12O6. Síðasta formúlan þýðir að glúkósi inniheldur 6 kolefnisatóm, 12 vetnisatóm og 6 súrefnisatóm.
Ákveðið efnaformúlu efnasambandsins. Þetta er fjöldi frumeinda í hverju frumefni efnasambandsins. (Þú finnur upplýsingar um þetta í til dæmis Binas) Til dæmis: formúlan fyrir vetnisklóríð (saltsýra) er HCl; fyrir glúkósa C6H.12O6. Síðasta formúlan þýðir að glúkósi inniheldur 6 kolefnisatóm, 12 vetnisatóm og 6 súrefnisatóm. 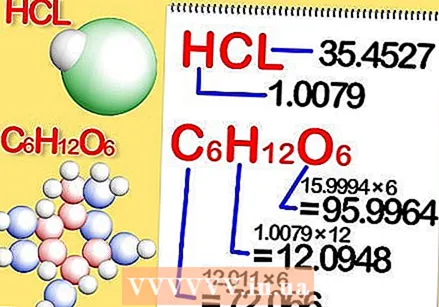 Finndu mólmassa hvers frumefnis í efnasambandinu. Margfaldaðu atómmassa frumefnisins með mólmassanum og fjölda atóma frumefnisins í efnasambandinu. Svona virkar þetta:
Finndu mólmassa hvers frumefnis í efnasambandinu. Margfaldaðu atómmassa frumefnisins með mólmassanum og fjölda atóma frumefnisins í efnasambandinu. Svona virkar þetta: - Mólmassi hvers frumefnis vetnisklóríðs, HCl, er 1.008 grömm á hvert mól af vetni og 35.453 grömm á hvert mól af klór.
- Mólmassi hvers frumefnis glúkósa, C.6H.12O6, er 12,0107 sinnum 6, eða 72,0642 grömm á hvert mól kolefni; 1.008 sinnum 12, eða 12.096 grömm á hvert mól af vetni; og 15.9994 sinnum 6, eða 95,9964 grömm á hvert súrefni.
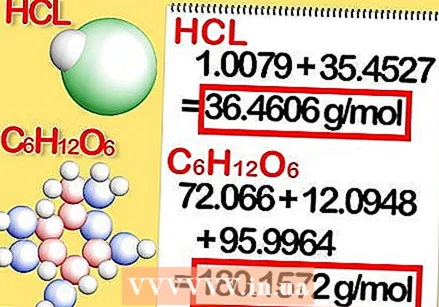 Bætið við molamassa hvers frumefnis í efnasambandinu. Þetta gefur molamassa efnasambandsins. Hér er hvernig:
Bætið við molamassa hvers frumefnis í efnasambandinu. Þetta gefur molamassa efnasambandsins. Hér er hvernig: - Mólmassi vetnisklóríðs er 1.008 + 35.453 eða 36.461 grömm á mól.
- Mólmassi glúkósa er 72,0642 + 12,096 + 95,9964, eða 180,1566 grömm á mól.
Ábendingar
- Þó að í flestum tilfellum hafi hlutfallslegir atómmassar nákvæmni 4 aukastafa, gildir á rannsóknarstofu nákvæmni 2 aukastafi eða minna fyrir óvenju stóra massa. Svo í rannsóknarstofunni er mólmassi vetnisklóríðs 36,46 grömm á hvert mol og glúkósi er 180,16 grömm á hvert mol.
Viðvaranir
- Ekki rugla saman mólmassa og mólmassa. Síðarnefndu er massi einstakrar sameindar frumefnis eða efnasambands. Mólmassa má skilja sem meðalmassa allra sameinda í sýni af tilteknu efni, rétt eins og hlutfallslegur atómmassi er meðaltal atómmassa allra samsæta.
Nauðsynjar
- Bínar og reglulegt frumefni
- Reiknivél