Höfundur:
Helen Garcia
Sköpunardag:
21 April. 2021
Uppfærsludagsetning:
1 Júlí 2024
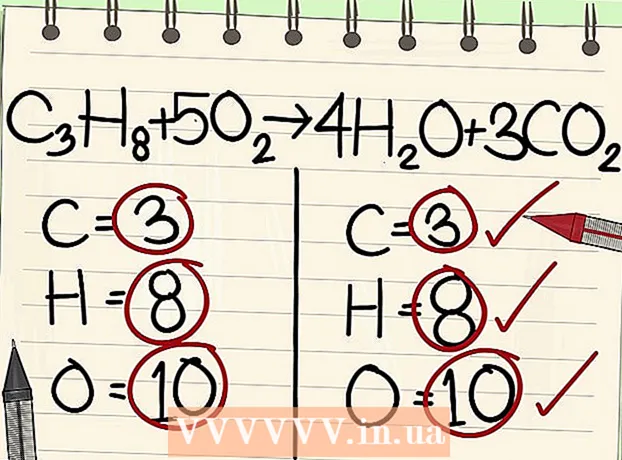
Efni.
Efnajöfnur er táknræn framsetning á efnahvörfum. Í þessu tilviki eru hvarfefnasamböndin (hvarfefni) skrifuð til vinstri og efnin sem myndast (hvarfefni) - hægra megin í jöfnunni. Ör er sett á milli þeirra frá vinstri til hægri, sem gefur til kynna hvar viðbrögðin verða. Samkvæmt lögum um varðveislu massa, við efnafræðileg viðbrögð geta ný atóm ekki birst eða gömul hverfa; þess vegna verður fjöldi atóma í hvarfefnunum að vera jafn fjöldi atóma í afurðum efnahvörfanna . Þessi grein lýsir því hvernig á að jafna efnajöfnur með mismunandi aðferðum.
Skref
Aðferð 1 af 2: Hefðbundin aðferð
 1 Skrifaðu niður efnajöfnuna. Sem dæmi skaltu íhuga eftirfarandi viðbrögð:
1 Skrifaðu niður efnajöfnuna. Sem dæmi skaltu íhuga eftirfarandi viðbrögð: - C3H8 + O2 -> H2O + CO2
- Þessi viðbrögð lýsa brennslu própans (C3H8) í nærveru súrefnis til að mynda vatn og koldíoxíð (koldíoxíð).
 2 Skrifaðu niður fjölda atóma fyrir hvert frumefni. Gerðu þetta fyrir báðar hliðar jöfnunnar. Takið eftir áskriftunum við hlið hvers frumefnis til að ákvarða heildarfjölda atóma. Skrifaðu niður táknið fyrir hvert frumefni í jöfnunni og athugaðu samsvarandi fjölda atóma.
2 Skrifaðu niður fjölda atóma fyrir hvert frumefni. Gerðu þetta fyrir báðar hliðar jöfnunnar. Takið eftir áskriftunum við hlið hvers frumefnis til að ákvarða heildarfjölda atóma. Skrifaðu niður táknið fyrir hvert frumefni í jöfnunni og athugaðu samsvarandi fjölda atóma. - Til dæmis, á hægri hlið jöfnunnar sem er til skoðunar, fáum við 3 súrefnisatóm vegna viðbótar.
- Á vinstri hliðinni höfum við 3 kolefnisatóm (C3), 8 vetnisatóm (H8) og 2 súrefnisatóm (O2).
- Hægra megin höfum við 1 kolefnisatóm (C), 2 vetnisatóm (H2) og 3 súrefnisatóm (O + O2).
 3 Geymið vetni og súrefni til seinna, þar sem þau eru hluti af nokkrum efnasamböndum vinstra og hægra megin. Vetni og súrefni eru hluti af nokkrum sameindum, svo það er best að halda þeim jafnvægi síðast.
3 Geymið vetni og súrefni til seinna, þar sem þau eru hluti af nokkrum efnasamböndum vinstra og hægra megin. Vetni og súrefni eru hluti af nokkrum sameindum, svo það er best að halda þeim jafnvægi síðast. - Áður en jafnvægi verður á vetni og súrefni verður þú að endurreisa atómin þar sem viðbótarþættir geta verið nauðsynlegir til að koma jafnvægi á aðra frumefni.
 4 Byrjaðu með hlutinn sem er sjaldnast tíður. Ef þú þarft að halda jafnvægi á nokkrum þáttum skaltu velja einn sem er hluti af einni hvarfefnasameind og einni sameind hvarfafurða. Þannig að kolefnið verður að vera í jafnvægi fyrst.
4 Byrjaðu með hlutinn sem er sjaldnast tíður. Ef þú þarft að halda jafnvægi á nokkrum þáttum skaltu velja einn sem er hluti af einni hvarfefnasameind og einni sameind hvarfafurða. Þannig að kolefnið verður að vera í jafnvægi fyrst.  5 Til að halda jafnvægi skaltu bæta við stuðli fyrir framan eitt kolefnisatóm. Settu þátt fyrir framan eina kolefnið á hægri hlið jöfnunnar til að jafna það með 3 kolefnum á vinstri hliðinni.
5 Til að halda jafnvægi skaltu bæta við stuðli fyrir framan eitt kolefnisatóm. Settu þátt fyrir framan eina kolefnið á hægri hlið jöfnunnar til að jafna það með 3 kolefnum á vinstri hliðinni. - C3H8 + O2 -> H2O + 3CO2
- Stuðull 3 fyrir framan kolefni á hægri hlið jöfnunnar gefur til kynna að það séu þrjú kolefnisatóm, sem samsvara kolefnisatómunum þremur í própan sameindinni vinstra megin.
- Í efnajöfnunni er hægt að breyta stuðlunum fyrir framan atóm og sameindir en undirritanir verða að vera óbreyttar.
 6 Jafnaðu síðan vetnisatómunum. Eftir að þú jafnaðir fjölda kolefnisatóma vinstra og hægra megin var vetni og súrefni ójafnvægi. Vinstri hlið jöfnunnar inniheldur 8 vetnisatóm, sama tala ætti að vera til hægri. Náðu þessu með hlutfalli.
6 Jafnaðu síðan vetnisatómunum. Eftir að þú jafnaðir fjölda kolefnisatóma vinstra og hægra megin var vetni og súrefni ójafnvægi. Vinstri hlið jöfnunnar inniheldur 8 vetnisatóm, sama tala ætti að vera til hægri. Náðu þessu með hlutfalli. - C3H8 + O2 -> 4H2O + 3CO2
- Við höfum bætt við stuðlinum 4 til hægri þar sem undirskriftin sýnir að við höfum þegar tvö vetnisatóm.
- Ef þú margfaldar þáttinn 4 með áskrift 2 færðu 8.
- Þess vegna fást 10 súrefnisatóm hægra megin: 3x2 = 6 atóm í þremur 3CO sameindum2 og fjögur atóm til viðbótar í fjórum vatnsameindum.
 7 Koma jafnvægi á súrefnisatóm. Mundu að taka þátt í stuðlunum sem þú notaðir til að koma jafnvægi á önnur atómin. Vegna þess að þú bættir við stuðlunum fyrir framan sameindirnar hægra megin í jöfnunni breyttist fjöldi súrefnisatóma. Þú ert nú með 4 súrefnisatóm í vatnsameindum og 6 súrefnisatóm í koltvísýringsameindum. Þannig eru 10 súrefnisatóm í hægri hliðinni.
7 Koma jafnvægi á súrefnisatóm. Mundu að taka þátt í stuðlunum sem þú notaðir til að koma jafnvægi á önnur atómin. Vegna þess að þú bættir við stuðlunum fyrir framan sameindirnar hægra megin í jöfnunni breyttist fjöldi súrefnisatóma. Þú ert nú með 4 súrefnisatóm í vatnsameindum og 6 súrefnisatóm í koltvísýringsameindum. Þannig eru 10 súrefnisatóm í hægri hliðinni. - Bættu stuðli 5 við súrefnissameindina vinstra megin í jöfnunni. Hvert stykki inniheldur nú 10 súrefnisatóm.
- C3H8 + 5O2 -> 4H2O + 3CO2.

- Þannig að báðar hliðar jöfnunnar innihalda sama fjölda kolefnis, vetnis og súrefnisatóma. Jafnan er í jafnvægi.
Aðferð 2 af 2: Algebraic Method
- 1 Skrifaðu niður hvarfjöfnuna. Sem dæmi skaltu íhuga eftirfarandi efnahvörf:
- PCl5 + H2O -> H3PO4 + HCl
- 2 Settu staf fyrir hverja tengingu:
- aPCl5 + bH2O -> cH3PO4 + dHCl
- 3 Jöfnuðu fjölda atóma fyrir hvert frumefni á vinstri og hægri hlið jöfnunnar.
- aPCl5 + bH2O -> cH3PO4 + dHCl
- Til vinstri höfum við 2b vetnisatóm (2 í hverju H2O), en til hægri er 3c+d vetnisatóm (3 í hverju H3PO4 og 1 í hverri HCl sameind). Þar sem vinstri og hægri hliðin verða að innihalda sama fjölda vetnisatóma, 2b ætti að vera 3c+d.
- Gerðu þetta fyrir alla þætti:
- P: a=c
- Cl: 5a=d
- H: 2b=3c+d
- 4 Leysið kerfið jöfnur til að finna töluleg gildi stuðlanna. Kerfið hefur nokkrar lausnir þar sem það eru fleiri breytur en jöfnur. Nauðsynlegt er að finna slíka lausn þannig að allir stuðlarnir séu með formi minnstu mögulegu heiltölu.
- Til að leysa fljótt kerfi jöfnu skal úthluta tölulegu gildi við eina af breytunum. Segjum að a = 1. Við skulum leysa kerfið og finna gildi breytanna sem eftir eru:
- Fyrir P a = c, svo c = 1
- Fyrir Cl 5a = d, því d = 5
- Þar sem fyrir H 2b = 3c + d finnum við gildi b:
- 2b = 3 (1) + 5
- 2b = 3 + 5
- 2b = 8
- b = 4
- Þannig höfum við eftirfarandi stuðla:
- a = 1
- b = 4
- c = 1
- d = 5
Ábendingar
- Ef þú átt í erfiðleikum er hægt að nota reiknivél á netinu til að jafna efnajöfnur. Vinsamlegast athugið þó að ekki er leyfilegt að nota slíka reiknivél meðan á prófinu stendur, svo ekki treysta eingöngu á hana.
- Mundu að stundum er hægt að einfalda jöfnuna! Ef allir stuðlar eru jafnvel deilanlegir með heiltölu, einfaldaðu jöfnu.
Viðvaranir
- Til að losna við brotstuðla, margfaldaðu alla jöfnuna (vinstri og hægri hlið hennar) með nefnara brotsins.
- Aldrei nota brot sem stuðla efnajöfnunnar - það eru engar hálf sameindir eða atóm í efnahvörfum.
- Í jafnvægisferlinu er hægt að nota brot til þæginda en jöfnu er ekki jafnvægi svo framarlega sem brotastuðlar eru í henni.