Höfundur:
Eric Farmer
Sköpunardag:
10 Mars 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
- Skref
- Aðferð 1 af 2: Ákvarða fjölda nifteinda í atómum (ekki samsætur)
- Aðferð 2 af 2: Ákvarða fjölda nifteinda í samsætum
- Ábendingar
Í atómum sama frumefnis er fjöldi róteinda stöðugur en fjöldi nifteinda getur verið breytilegur.Með því að vita hversu mörg nifteindir tiltekið atóm inniheldur geturðu ákvarðað hvort það er venjulegt atóm eða samsæta sem mun hafa færri eða fleiri nifteindir. Að ákvarða fjölda nifteinda í atómi er frekar einfalt. Allt sem þú þarft að gera til að reikna út fjölda nifteinda í atómi eða samsætu er að fylgja leiðbeiningum okkar og hafa lotukerfið við höndina.
Skref
Aðferð 1 af 2: Ákvarða fjölda nifteinda í atómum (ekki samsætur)
 1 Finndu frumefnið á lotukerfinu. Sem dæmi munum við íhuga osmíum (Os), sem er á sjötta tímabili (sjötta röð ofan frá).
1 Finndu frumefnið á lotukerfinu. Sem dæmi munum við íhuga osmíum (Os), sem er á sjötta tímabili (sjötta röð ofan frá).  2 Finndu lotukerfi frumefnisins. Þetta er að jafnaði mest áberandi tala í frumu frumefnis og er venjulega staðsett fyrir ofan tákn þess (í útgáfu lotukerfisins sem við notum í dæminu okkar eru engar aðrar tölur). Atómtalan er fjöldi róteinda í einu atómi þess frumefnis. Fyrir osmíum er þessi tala 76, það er að segja, það eru 76 róteindir í einu osmíumatómi.
2 Finndu lotukerfi frumefnisins. Þetta er að jafnaði mest áberandi tala í frumu frumefnis og er venjulega staðsett fyrir ofan tákn þess (í útgáfu lotukerfisins sem við notum í dæminu okkar eru engar aðrar tölur). Atómtalan er fjöldi róteinda í einu atómi þess frumefnis. Fyrir osmíum er þessi tala 76, það er að segja, það eru 76 róteindir í einu osmíumatómi. - Fjöldi róteinda er óbreyttur og þetta er það sem gerir frumefni að frumefni.
 3 Finndu atómmassa frumefnis. Þessi tala er venjulega að finna fyrir neðan frumstáknið. Vinsamlegast athugaðu að í útgáfu lotukerfisins í dæminu okkar er atómmassi ekki gefinn upp (þetta er ekki alltaf raunin; í mörgum útgáfum lotukerfisins er atómmassinn tilgreindur). Atómmassi osmíums er 190,23.
3 Finndu atómmassa frumefnis. Þessi tala er venjulega að finna fyrir neðan frumstáknið. Vinsamlegast athugaðu að í útgáfu lotukerfisins í dæminu okkar er atómmassi ekki gefinn upp (þetta er ekki alltaf raunin; í mörgum útgáfum lotukerfisins er atómmassinn tilgreindur). Atómmassi osmíums er 190,23.  4 Hringið atómmassann í næstu heilu tölu. Í okkar dæmi er 190.23 námundað í 190.
4 Hringið atómmassann í næstu heilu tölu. Í okkar dæmi er 190.23 námundað í 190. - Atómmassi er meðal fjöldi samsætna tiltekins frumefnis, venjulega er það ekki gefið upp sem heil tala.
 5 Dragðu atómtöluna frá atómmassanum. Þar sem róteindir og nifteindir taka tillit til algerrar hluta atómmassans, dregur fjöldi róteinda (það er atómafjöldinn, sem er jafn fjöldi róteinda) frá atómmassanum frá fjölda nifteinda í atóminu. Tölurnar á eftir aukastafnum vísa til mjög lítillar massa rafeinda í atómi. Í dæminu okkar: 190 (atómþyngd) - 76 (fjöldi róteinda) = 114 (fjöldi nifteinda).
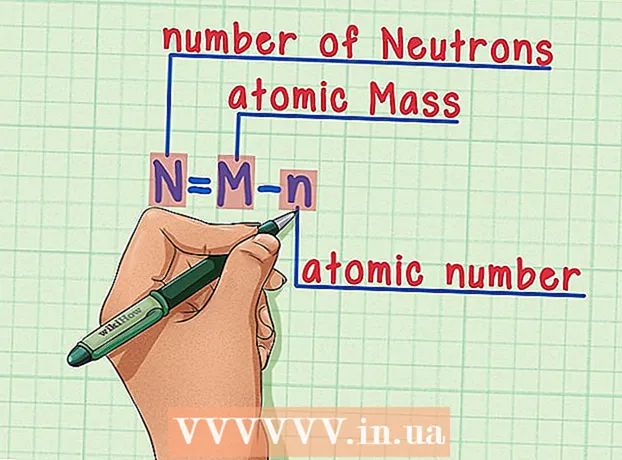
5 Dragðu atómtöluna frá atómmassanum. Þar sem róteindir og nifteindir taka tillit til algerrar hluta atómmassans, dregur fjöldi róteinda (það er atómafjöldinn, sem er jafn fjöldi róteinda) frá atómmassanum frá fjölda nifteinda í atóminu. Tölurnar á eftir aukastafnum vísa til mjög lítillar massa rafeinda í atómi. Í dæminu okkar: 190 (atómþyngd) - 76 (fjöldi róteinda) = 114 (fjöldi nifteinda).  6 Mundu eftir formúlunni. Til að finna fjölda nifteinda í framtíðinni skaltu einfaldlega nota þessa formúlu:
6 Mundu eftir formúlunni. Til að finna fjölda nifteinda í framtíðinni skaltu einfaldlega nota þessa formúlu: - N = M - n
- N = fjöldi nifteinda
- M = atómmassi
- n = lotukerfi
- N = M - n
Aðferð 2 af 2: Ákvarða fjölda nifteinda í samsætum
 1 Finndu frumefnið á lotukerfinu. Sem dæmi munum við íhuga samsætu kolefnis 14C. Þar sem kolefnið sem er ekki ísótópískt 14C er bara kolefni C, finndu kolefni á lotukerfinu (annað tímabil eða önnur röð ofan frá).
1 Finndu frumefnið á lotukerfinu. Sem dæmi munum við íhuga samsætu kolefnis 14C. Þar sem kolefnið sem er ekki ísótópískt 14C er bara kolefni C, finndu kolefni á lotukerfinu (annað tímabil eða önnur röð ofan frá).  2 Finndu lotukerfi frumefnisins. Þetta er að jafnaði mest áberandi tala í frumu frumefnis og er venjulega staðsett fyrir ofan tákn þess (í útgáfu lotukerfisins sem við notum í dæminu okkar eru engar aðrar tölur). Atómtalan er fjöldi róteinda í einu atómi þess frumefnis. Kolefni er númer 6, sem þýðir að eitt kolefni hefur sex róteindir.
2 Finndu lotukerfi frumefnisins. Þetta er að jafnaði mest áberandi tala í frumu frumefnis og er venjulega staðsett fyrir ofan tákn þess (í útgáfu lotukerfisins sem við notum í dæminu okkar eru engar aðrar tölur). Atómtalan er fjöldi róteinda í einu atómi þess frumefnis. Kolefni er númer 6, sem þýðir að eitt kolefni hefur sex róteindir.  3 Finndu atómmassann. Þegar um samsætur er að ræða er þetta mjög auðvelt að gera þar sem þeir eru nefndir samkvæmt atómmassa sínum. Í okkar tilviki hefur kolefni 14C atómmassa 14. Nú vitum við atómmassa samsætunnar; síðara útreikningsferlið er það sama og til að ákvarða fjölda nifteinda í atómum (ekki samsætum).
3 Finndu atómmassann. Þegar um samsætur er að ræða er þetta mjög auðvelt að gera þar sem þeir eru nefndir samkvæmt atómmassa sínum. Í okkar tilviki hefur kolefni 14C atómmassa 14. Nú vitum við atómmassa samsætunnar; síðara útreikningsferlið er það sama og til að ákvarða fjölda nifteinda í atómum (ekki samsætum).  4 Dragðu atómtöluna frá atómmassanum. Þar sem róteindir og nifteindir taka til heildarhluta atómmassans, dregur fjöldi róteinda (það er atómafjöldinn, sem er jafn fjöldi róteinda) frá atómmassanum, gefur fjölda nifteinda í atóminu. Í dæminu okkar: 14 (atómmassi) - 6 (fjöldi róteinda) = 8 (fjöldi nifteinda).
4 Dragðu atómtöluna frá atómmassanum. Þar sem róteindir og nifteindir taka til heildarhluta atómmassans, dregur fjöldi róteinda (það er atómafjöldinn, sem er jafn fjöldi róteinda) frá atómmassanum, gefur fjölda nifteinda í atóminu. Í dæminu okkar: 14 (atómmassi) - 6 (fjöldi róteinda) = 8 (fjöldi nifteinda).  5 Mundu eftir formúlunni. Til að finna fjölda nifteinda í framtíðinni skaltu einfaldlega nota þessa formúlu:
5 Mundu eftir formúlunni. Til að finna fjölda nifteinda í framtíðinni skaltu einfaldlega nota þessa formúlu: - N = M - n
- N = fjöldi nifteinda
- M = atómmassi
- n = lotukerfi
- N = M - n
Ábendingar
- Róteindir og nifteindir mynda nánast algeran massa frumefna, en rafeindir og aðrar agnir mynda afar óverulegan massa (þessi massa hefur tilhneigingu til núlls).Þar sem ein róteind hefur um það bil sama massa og ein nifteind og atómtala er fjöldi róteinda geturðu einfaldlega dregið úr fjölda róteinda frá heildarmassanum.
- Osmium - málmur í föstu ástandi við stofuhita, fékk nafn sitt frá gríska orðinu „osme“ - lykt.
- Ef þú ert ekki viss um hvað tala í lotukerfinu þýðir, mundu: taflan er venjulega byggð í kringum atómtölu (það er fjöldi róteinda), sem byrjar á 1 (vetni) og vex eina einingu frá vinstri til hægri , endar með 118 (Oganesson). Þetta er vegna þess að fjöldi róteinda í atómi ákvarðar frumefnið sjálft og slík tala er auðveldasta leiðin til að skipuleggja frumefnin (til dæmis er atóm með 2 róteindum alltaf helíum, rétt eins og atóm með 79 róteindir er alltaf gull ).