Höfundur:
Florence Bailey
Sköpunardag:
21 Mars 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
- Skref
- Aðferð 1 af 2: Dreifing rafeinda með því að nota lotukerfi D. I. Mendeleevs
- Aðferð 2 af 2: Notkun ADOMAH lotukerfisins
- Ábendingar
Rafræn uppsetning atóm er töluleg framsetning rafeinda sporbrauta þess. Rafræn sporbrautir eru svæði af ýmsum stærðum sem eru staðsettar í kringum atómkjarna þar sem rafeind er stærðfræðilega líkleg. Rafræn uppsetning hjálpar til við að fljótt og auðveldlega segja lesandanum hversu mörg rafeindabrautir atóm hefur, auk þess að ákvarða fjölda rafeinda í hverju sporbraut. Eftir að hafa lesið þessa grein muntu hafa náð tökum á aðferðinni við að búa til rafrænar stillingar.
Skref
Aðferð 1 af 2: Dreifing rafeinda með því að nota lotukerfi D. I. Mendeleevs
 1 Finndu atómnúmer atóms þíns. Hvert atóm hefur sérstakan fjölda rafeinda sem tengjast því. Finndu táknið fyrir atómið þitt í lotukerfinu. Atómtala er jákvæð heil tala sem byrjar á 1 (fyrir vetni) og eykst um eina fyrir hvert atóm í kjölfarið. Atóm tala er fjöldi róteinda í atómi og þess vegna er það einnig fjöldi rafeinda í atómi með núllhleðslu.
1 Finndu atómnúmer atóms þíns. Hvert atóm hefur sérstakan fjölda rafeinda sem tengjast því. Finndu táknið fyrir atómið þitt í lotukerfinu. Atómtala er jákvæð heil tala sem byrjar á 1 (fyrir vetni) og eykst um eina fyrir hvert atóm í kjölfarið. Atóm tala er fjöldi róteinda í atómi og þess vegna er það einnig fjöldi rafeinda í atómi með núllhleðslu. - 2 Ákveðið hleðslu atóms. Hlutlaus atóm munu hafa sama fjölda rafeinda og sýnt er í lotukerfinu. Hins vegar munu hlaðin atóm hafa fleiri eða færri rafeindir, allt eftir hleðslumagninu. Ef þú ert að vinna með hlaðna atóm skaltu bæta við eða draga frá rafeindum eins og hér segir: bættu við einni rafeind fyrir hverja neikvæða hleðslu og dragðu eina frá fyrir hverja jákvæða.
- Til dæmis mun natríumatóm með hleðslu -1 hafa aukarafeind Auk þess að grunnatómatölu sinni 11. Með öðrum orðum, heildar atómið mun hafa 12 rafeindir.
- Ef við erum að tala um natríumatóm með hleðslu +1 þá verður að draga eina rafeind frá grunnatómatölu 11. Þannig mun atómið hafa 10 rafeindir.
- 3 Mundu eftir grunnlista yfir sporbrautir. Þegar rafeindunum fjölgar fylla þær hinar ýmsu undirstærðir rafeindaskeljar atómsins í samræmi við ákveðna röð. Hver undirstig rafeindaskeljarinnar, þegar hún er fyllt, inniheldur jafnmarga rafeindir. Eftirfarandi undirstig eru í boði:
- s-undirstig (hvaða númer í rafeindastillingunni sem er fyrir bókstafinn „s“) inniheldur eitt sporbraut og skv Meginregla Pauli, eitt sporbraut getur innihaldið að hámarki 2 rafeindir, þess vegna geta verið 2 rafeindir á hverri s-undirlínu rafeindaskeljarinnar.
- p-undirstig inniheldur 3 svigrúm og getur því að hámarki innihaldið 6 rafeindir.
- d-undirstig inniheldur 5 sporbrautir, þannig að það getur haft allt að 10 rafeindir.
- f-undirstig inniheldur 7 sporbrautir, þannig að það getur haft allt að 14 rafeindir.
- g-, h-, i- og k-undirstig eru fræðileg. Atóm sem innihalda rafeindir í þessum sporbrautum eru óþekkt. G-undirstigið inniheldur 9 sporbrautir þannig að fræðilega gæti það verið með 18 rafeindir. H-undirstigið getur haft 11 sporbrautir og að hámarki 22 rafeindir; í i -sublevel -13 sporbrautunum og að hámarki 26 rafeindir; í k -undirstiginu - 15 sporbrautir og að hámarki 30 rafeindir.
- Minnið röð sporbrautanna með því að nota mnemonic bragðið:
Sober Bldulfræðingar Dá ekki Find Giraffes Hiding Égn Kkláði (edrú eðlisfræðingar finna ekki gíraffa leynast í eldhúsum).
- 4 Skilja rafræna stillingarskrána. Rafrænar stillingar eru skráðar til að endurspegla skýrt fjölda rafeinda í hverju sporbraut. Hringbrautir eru skrifaðar í röð, þar sem fjöldi atóma í hverju sporbraut er yfirskrift hægra megin við brautarheiti. Fullkomin rafræn uppsetning er í formi röð undirnáms og yfirskrifta.
- Til dæmis einfaldasta rafræna uppsetningin: 1s 2s 2p. Þessi uppsetning sýnir að það eru tvær rafeindir á 1s undirstiginu, tvær rafeindir á 2s undirstiginu og sex rafeindir á 2p undirstiginu. 2 + 2 + 6 = 10 rafeindir samtals. Þetta er rafræn uppsetning hlutlausrar neon atóms (atómtala neon er 10).
- 5 Mundu eftir röð sporbrautanna. Hafðu í huga að rafeinda sporbrautir eru númeraðar í hækkandi röð rafeindaskeljar, en í hækkandi orku röð. Til dæmis er fyllt 4s braut orkuminna (eða minna hreyfanlegt) en 3d fyllt eða fyllt 3d þannig að 4s brautin er skráð fyrst. Þegar þú hefur þekkt röð sporbrautanna geturðu auðveldlega fyllt þau út í samræmi við fjölda rafeinda í atóminu. Skipunin um að fylla brautirnar er sem hér segir: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Rafræn uppsetning atóms þar sem allar brautir eru fylltar mun hafa eftirfarandi form: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Athugið að ofangreind færsla, þegar allar sporbrautir eru fylltar, er rafræn uppsetning frumefnisins Uuo (ununoctium) 118, hæsta númeraða atóms í lotukerfinu. Þess vegna inniheldur þessi rafræna uppsetning öll þekkt rafræn undirstig hlutlausrar hlaðinnar atóms.
- 6 Fylltu út sporbrautirnar í samræmi við fjölda rafeinda í atóminu þínu. Til dæmis, ef við viljum skrifa niður rafræna stillingu hlutlauss kalsíumatóms, verðum við að byrja á því að leita að lotukerfinu í lotukerfinu. Atómnúmer hennar er 20, þannig að við munum skrifa uppsetningu atóms með 20 rafeindum samkvæmt ofangreindri röð.
- Fylltu út brautirnar í röðinni hér að ofan þar til þú nærð tuttugustu rafeindinni. Fyrsta 1s brautin mun innihalda tvær rafeindir, 2s sporbrautirnar munu einnig hafa tvær, 2p - sex, 3s - tvær, 3p - 6 og 4s - 2 (2 + 2 + 6 +2 + 6 + 2 = 20.) Í með öðrum orðum, rafræn uppsetning kalsíums er: 1s 2s 2p 3s 3p 4s.
- Athugið að sporbrautirnar eru í hækkandi orkuskrá. Til dæmis, þegar þú ert tilbúinn að fara á 4. orkustig, þá skrifaðu fyrst niður 4s brautina og Þá 3d. Eftir fjórða orkustigið ferðu í það fimmta, þar sem sama röð er endurtekin. Þetta gerist aðeins eftir þriðja orkustigið.
- 7 Notaðu lotukerfið sem sjónræna vísbendingu. Þú hefur sennilega þegar tekið eftir því að lögun lotukerfisins samsvarar röð rafrænna undirstiga í rafrænum stillingum. Til dæmis enda atómin í öðrum dálknum frá vinstri alltaf á „s“ en atómin á hægri brún þunnar miðhluta enda alltaf á „d“ o.s.frv. Notaðu lotukerfið sem sjónræn leiðarvísir við að skrifa stillingar - þar sem röðin sem þú bætir við sporbrautir samsvarar staðsetningu þinni í töflunni. Sjá fyrir neðan:
- Sérstaklega innihalda tveir dálkarnir til vinstri frumeindir þar sem rafrænar stillingar enda í s-sporbrautum, hægri blokk töflunnar inniheldur atóm þar sem stillingar enda í p-sporbrautum og í neðri hluta atóma enda í f-sporbrautum.
- Til dæmis, þegar þú skrifar niður rafræna stillingu klórs, hugsaðu svona: "Þetta atóm er staðsett í þriðju röðinni (eða" tímabilinu ") í lotukerfinu. Það er einnig staðsett í fimmta hópnum í svigrúminu reglubundna kerfisins. Þess vegna mun rafræn uppsetning þess enda á .3p
- Vinsamlegast athugið: frumefnin á svæði d og f sporbrauta töflunnar einkennast af orkustigi sem samsvarar ekki tímabilinu þar sem þeir eru staðsettir. Til dæmis samsvarar fyrsta röð frumefnisblokkarinnar með d-sporbrautum 3d sporbrautum, þó að hún sé staðsett á 4. tímabili, og fyrsta röð frumefna með f-sporbrautum samsvarar 4f brautinni, þrátt fyrir að það sé er á 6. tímabili.
- 8 Lærðu skammstöfunina til að skrifa langar rafrænar stillingar. Atómin á hægri brún lotukerfisins eru kölluð göfugar lofttegundir. Þessir þættir eru efnafræðilega mjög stöðugir. Til að stytta ferlið við að skrifa langar rafrænar stillingar skaltu einfaldlega skrifa í hornklofa efnatákn næsta göfuga gas með færri rafeindum en atómið þitt og halda síðan áfram að skrifa rafræna stillingu síðari brautargilda. Sjá fyrir neðan:
- Til að skilja þetta hugtak er gagnlegt að skrifa dæmi um stillingar. Skrifum stillingar fyrir sink (lotukerfi 30) með því að nota göfuga skammstöfunina. Heill sinkstillingin lítur svona út: 1s 2s 2p 3s 3p 4s 3d. Hins vegar sjáum við að 1s 2s 2p 3s 3p er rafræn uppsetning argons, göfugs gas. Skiptu einfaldlega um rafræna stillingarhlutann af sinki með efnatákninu argon innan hornklofa ([Ar].)
- Svo, rafræn uppsetning sink, skrifuð í styttri mynd, er: [Ar] 4s 3d.
- Athugaðu að ef þú ert að skrifa rafræna stillingu göfugs gas, segðu argon, þá geturðu ekki skrifað [Ar]! Maður verður að nota minnkun á göfugu gasi sem snýr að þessum frumefni; fyrir argon verður það neon ([Ne]).
Aðferð 2 af 2: Notkun ADOMAH lotukerfisins
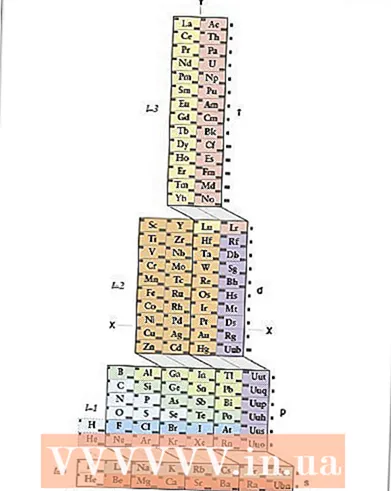
 1 Lærðu ADOMAH lotukerfið. Þessi aðferð til að taka upp rafræna stillingu þarf ekki að leggja á minnið, hún krefst hins vegar endurskoðaðrar lotukerfis þar sem í hefðbundnu lotukerfinu, frá og með fjórða tímabilinu, samsvarar tímabilið ekki rafeindaskelinni. Finndu ADOMAH lotukerfið - sérstaka gerð lotukerfis þróað af vísindamanninum Valery Zimmerman. Það er auðvelt að finna það með stuttri leit á netinu.
1 Lærðu ADOMAH lotukerfið. Þessi aðferð til að taka upp rafræna stillingu þarf ekki að leggja á minnið, hún krefst hins vegar endurskoðaðrar lotukerfis þar sem í hefðbundnu lotukerfinu, frá og með fjórða tímabilinu, samsvarar tímabilið ekki rafeindaskelinni. Finndu ADOMAH lotukerfið - sérstaka gerð lotukerfis þróað af vísindamanninum Valery Zimmerman. Það er auðvelt að finna það með stuttri leit á netinu. - Í lotukerfi ADOMAH tákna láréttar raðir hópa frumefna eins og halógena, göfuga lofttegunda, basískra málma, jarðalkalímálma osfrv. Lóðréttir dálkar samsvara rafrænum stigum og svokölluð „cascades“ (ská línur sem tengja blokkir s, p, d og f) samsvara tímabilum.
- Helíum er flutt í vetni þar sem báðir þessir frumefni hafa 1s braut. Punktablokkir (s, p, d og f) eru sýndar hægra megin og stigatölur eru sýndar neðst. Frumefni eru sýnd í reitum númer 1 til 120. Þessar tölur eru algengar atómtölur sem tákna heildarfjölda rafeinda í hlutlausu atómi.
- 2 Finndu atómið þitt í ADOMAH töflunni. Til að skrá rafræna stillingu frumefnis skaltu finna tákn þess í ADOMAH lotukerfinu og strika yfir öll frumefni með hærra lotukerfi. Til dæmis, ef þú þarft að skrifa niður rafræna stillingu erbíums (68), strikaðu yfir alla þætti frá 69 til 120.
- Takið eftir tölunum 1 til 8 neðst á töflunni. Þetta eru rafræn stigatölur, eða dálknúmer. Hunsa dálka sem innihalda aðeins yfirstrikaða atriði.Fyrir erbíum eru dálkarnir númeraðir 1, 2, 3, 4, 5 og 6 eftir.
- 3 Telja sporbrautar undirstig við frumefnið þitt. Þegar litið er á reitartáknin sem sýnd eru til hægri í töflunni (s, p, d og f) og dálknúmerin sem sýnd eru neðst, hunsaðu skástrikin milli reitanna og skiptu dálkunum í dálkablokka í röð frá botni til topps. Aftur, hunsaðu reitina þar sem allir þættirnir eru strikaðir. Skrifaðu niður dálkablokkirnar, byrjaðu á dálknúmerinu og síðan á blokkartákninu, þannig: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (fyrir erbium).
- Athugið: Ofangreind rafræn uppsetning Er er skrifuð í hækkandi röð á rafrænu undirstigsnúmerinu. Það er einnig hægt að skrifa í þeirri röð að fylla sporbrautirnar. Til að gera þetta, fylgdu fossunum frá botni upp, ekki dálkana þegar þú skrifar dálkablokkirnar: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- 4 Telja rafeindirnar fyrir hverja rafræna undirstig. Teljið frumefnin í hverjum reitarsúlu sem ekki var strikað yfir, festu eina rafeind frá hverju frumefni og skrifaðu númerið þeirra við hliðina á reitartákninu fyrir hvern dálkdálk sem hér segir: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s ... Í dæminu okkar er þetta rafræn uppsetning erbíums.
- 5 Íhugaðu rangar rafrænar stillingar. Það eru átján dæmigerðar undantekningar sem tengjast rafrænum stillingum atóma í lægsta orkuástandi, einnig kallað jarðorkuástand. Þeir hlýða ekki almennu reglunni aðeins í síðustu tveimur eða þremur stöðum sem rafeindir hafa haft. Í þessu tilfelli gerir raunveruleg rafræn uppsetning ráð fyrir að rafeindirnar séu í ástandi með minni orku í samanburði við staðlaða stillingu atómsins. Undantekningaratóm eru:
- Kr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mo (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Gd (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Þ (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) og Sentimetri (..., 5f7, 6d1, 7s2).
Ábendingar
- Til að finna atómtölu atóms þegar hún er skrifuð í rafrænni stillingu, einfaldlega skaltu leggja saman allar tölurnar sem fylgja bókstöfunum (s, p, d og f). Þetta virkar aðeins fyrir hlutlaus atóm, ef þú ert að fást við jón, þá mun ekkert virka - þú verður að bæta við eða draga frá fjölda aukra eða týndra rafeinda.
- Númerið á eftir bréfinu er yfirskrift, ekki gera mistök í ávísuninni.
- Það er engin „stöðugleiki hálffylltrar“ undirstigs. Þetta er einföldun. Allur stöðugleiki sem tengist „hálffylltu“ undirstigunum stafar af því að hver braut er upptekin af einni rafeind, þannig að fráhrindun milli rafeinda er lágmörkuð.
- Hvert atóm hefur tilhneigingu til stöðugs ástands og stöðugustu stillingarnar hafa fyllt undirstig s og p (s2 og p6). Göfugar lofttegundir hafa slíka stillingu, því þær koma sjaldan í viðbrögð og eru staðsettar til hægri í lotukerfinu. Þess vegna, ef uppsetningin endar á 3p, þá þarf hún tvær rafeindir til að ná stöðugu ástandi (til að missa sex, þar með talið rafeindir á s-undirstiginu, þarf meiri orku, svo það er auðveldara að missa fjórar). Og ef uppsetningin endar á 4d, þá þarf hún að missa þrjár rafeindir til að ná stöðugu ástandi. Að auki eru hálffylltar undirstig (s1, p3, d5 ..) stöðugri en til dæmis p4 eða p2; þó, s2 og p6 verða enn öflugri.
- Þegar þú ert að fást við jón þýðir þetta að fjöldi róteinda er ekki jafn fjöldi rafeinda. Í þessu tilfelli verður hleðsla atóms sýnd efst til hægri (að jafnaði) efnatáknsins. Þess vegna hefur antímónatóm með hleðslu +2 rafræna stillingu 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Athugið að 5p hefur breyst í 5p. Vertu varkár þegar uppsetning hlutlauss atóms endar á öðrum undirstigum en s og bls. Þegar þú sækir rafeindir geturðu aðeins tekið þær upp úr gildisbrautum (s og p sporbrautum).Þess vegna, ef uppsetningin endar á 4s 3d og atómið fær +2 hleðslu, þá mun uppsetningin enda á 4s 3d. Vinsamlegast athugið að 3d ekki breytingar, í stað þess að missa s-brautarafeindir.
- Það eru aðstæður þegar rafeindin neyðist til að „fara á hærra orkustig“. Þegar undirstig vantar eina rafeind í hálfa eða fulla fyllingu skaltu taka eina rafeind frá næstu s eða p-undirstigi og færa hana á undirstigið sem þarf rafeind.
- Það eru tveir möguleikar til að taka upp rafræna stillingu. Hægt er að skrifa þau í hækkandi röð orkustigs tölum eða í röð þeirra sem rafeindabrautir fylla, eins og sýnt var hér að ofan fyrir erbíum.
- Þú getur líka skrifað niður rafræna stillingu frumefnis með því að skrifa aðeins gildisstillingu, sem er síðasta s og p undirstigið. Þannig mun gildisuppsetning antímon hafa formið 5s 5p.
- Jónas er ekki það sama. Það er miklu erfiðara með þá. Slepptu tveimur stigum og fylgdu sama mynstri eftir því hvar þú byrjaðir og hve mikill rafeindafjöldinn er.