Höfundur:
Lewis Jackson
Sköpunardag:
6 Maint. 2021
Uppfærsludagsetning:
1 Júlí 2024
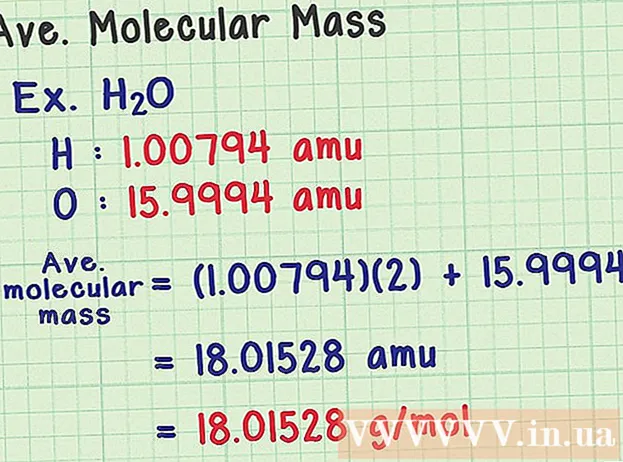
Efni.
Meðalmassatóm er ekki bein mælikvarði á massa atóms. Í staðinn er þetta meðalmassinn á hvert atóm úr dæmigerðu sýni frumefnisins. Ef þú getur mælt massa milljarða einstakra atóma geturðu fundið það með því að reikna meðaltal þeirra. Við höfum hagnýtari aðferð, sem byggir á upplýsingum um mismunandi samsætur efnaefnisins.
Skref
Hluti 1 af 2: Reiknaðu meðalmassatóm
Skilja samsætur og massa atóm. Í náttúrunni eru flestir þættir til í mörgum myndum eða samsætum. Eini munurinn á tveimur samsætum sama frumefnis er fjöldi nifteinda í frumeindinni, en fjöldi nifteinda hefur áhrif á massa frumeindina. Útreikningur á meðalmassatómi tekur mið af áhrifum þessa munar og segir þér meðalmassa hvers atóms í sýni þessara atóma.
- Til dæmis hefur frumefni silfur (Ag) tvær náttúrulegar samsætur: Ag-107 og Ag-109 (eða Ag og Ag). Samsætan er nefnd eftir „massatölunni“, eða summan af fjölda róteinda og fjölda nifteinda í atómi. Það þýðir að Ag-109 hefur tvö nifteindir fleiri en Ag-107, þannig að atóm þess er aðeins þyngra.

Finndu massa hverrar samsætu. Þú þarft tvær upplýsingar fyrir hverja samsætuna, þú getur flett þeim upp í uppflettiritum eða flett upp á netinu, til dæmis webelements.com. Það fyrsta er massa atóm eða atómmassi hverrar samsætu. Samsætur með fleiri nifteindir hafa meiri massa.- Til dæmis hefur silfur samsætan Ag-107 massa atómið 106.90509 amu (einingin á rúmmetri). Samsæta Ag-109 er aðeins þyngri með massa 108,90470.
- Tugabrotin í lokin geta verið aðeins frábrugðin í skjölunum. Ekki skrifa neinar tölur innan sviga eftir messuna.

Skrifaðu náttúrulega lifunartíðni fyrir hverja samsætuna. Þetta hlutfall gefur til kynna algengi samsætunnar, sem hlutfall af heildaratómum frumefnisins. Þú getur fundið þessar upplýsingar í sama skjali með rúmmáli. Náttúruleg lifun allra samsæta ætti að vera 100% (þó að hún geti verið svolítið frábrugðin vegna skekkju við hringmyndun).- Ag-107 samsætan hefur hlutfallið 51,86%. Samsætan Ag-109 er sjaldgæfari á genginu 48,14%. Það þýðir að venjulegt silfursýni hefur 51,86% Ag-107 og 48,14% Ag-109.
- Allar samsætur sem hafa ekki þessa lifunartíðni eru hunsaðar. Þessar samsætur eru ekki til náttúrulega á jörðinni.

Umreikna samsætuprósentuna í aukastaf. Deildu þessu hlutfalli með 100 mun skila sama gildi og aukastaf.- Í silfursýninu hér að ofan er hlutfall samsæta 51,86 / 100 = 0,5186 og 48,14 / 100 = 0,4814.
Finndu meðaltals rúmmatóm. Meðalmassatóm frumefnis hefur n samsætur jafnar (Atomic BlockSamsæta 1 * hlutfallSamsæta 1) + (atómmassiSamsæta 2 * hlutfallSamsæta 2) + ... + (atómmassisamsætur n * hlutfallsamsætur n. Þetta er dæmi um „meðalmassa“, sem þýðir að því meiri sem lifun samsætunnar er, þeim mun meiri áhrif hefur hún á niðurstöðuna. Hvernig nota á þessa formúlu fyrir silfur er eftirfarandi:
- Medium massi atómAg = (rúmmetra atómAg-107 * hlutfallAg-107) + (atómmassiAg-109 * hlutfallAg-109)
=(106,90509 * 0,5186) + (108,90470 * 0,4814)
= 55,4410 + 52,4267
= 107,8677 amu. - Finndu þann þátt í reglulegu töflu til að kanna niðurstöðurnar. Meðaltal rúmmatóm er alltaf skrifað undir efnatákn frumefnisins.
- Medium massi atómAg = (rúmmetra atómAg-107 * hlutfallAg-107) + (atómmassiAg-109 * hlutfallAg-109)
2. hluti af 2: Notkun niðurstaðna
Umreikna massa í lotu númer. Meðalmassatóm sýnir samband massans og fjölda atóma í dæmigerðu sýni þess frumefnis. Þetta er mjög gagnlegt á efnarannsóknarstofum vegna þess að það er næstum ómögulegt að telja atóm nákvæmlega en auðvelt er að ákvarða massa. Til dæmis gætirðu vegið sýnishorn af silfri og vitað að það verður eitt silfuratóm fyrir hverja 107.8677 amu.
Umreikna í mólmassa. Atómmassaeiningin er mjög lítil og því nota efnafræðingar grammeininguna oft til massa. Sem betur fer höfum við skilgreiningar á þessum hugtökum svo umbreytingin ætti að vera auðveld. Margfaldaðu meðaltalsmassatómið bara með 1 g / mól (molamassafasti) til að fá niðurstöðu í g / mól. Til dæmis, 107.8677 grömm af silfri innihalda eitt mól af silfuratómum.
Finndu meðaltals sameindarmassa. Þar sem sameind er safn frumeinda, getur þú bætt við massa allra frumeinda til að finna sameindarmassa. Ef þú myndir nota meðalmassatóm (í stað massa tiltekinnar samsætu), þá yrði niðurstaðan meðaltalsmólmassi sýnis í náttúrunni. Hér er dæmi:
- Vatnssameind hefur efnaformúluna H2O inniheldur tvö vetnisatóm (H) og eitt súrefni (O) atóm.
- Vetni hefur að meðaltali massa atóm 1,00794 amu. Súrefni hefur atómmassa að meðaltali 15.9994 amu.
- Svo meðaltalsmólmassi H2O er jafnt og (1.00794) (2) + 15.9994 = 18.01528 amu, sem jafngildir 18.01528 g / mól.
Ráð
- Hugtakið hlutfallsleg atómmassi er stundum notað samheiti með meðalmassatóm. Það er lítill munur vegna þess að atómmassi er tiltölulega eining; það er mæling á massa miðað við kolefni-12 atóm. Svo framarlega sem þú notar atómmassaeininguna í meðaltali útreiknings á rúmmetri eru þessi tvö gildi þau sömu.
- Talan í sviga eftir rúmmálinu segir okkur villuna. Til dæmis þýðir massa atóm 1.0173 (4) að eðlilegt atóm frumefnisins hefur massasvið um 1.0173 ± 0.0004. Þú þarft ekki að fá þetta númer ef ekki er óskað eftir því.
- Í reglulegu töflu er meðaltal rúmmetóms eftirfarandi frumefnis stærra en það á undan, með fáum undantekningum. Hér er fljótleg leið til að athuga árangur þinn.
- 1 atómmassaeining er 1/12 massi kolefnis-12 atóms.
- Lífshlutfall samsætna er reiknað samkvæmt dæmigerðum náttúrulegum sýnum á jörðinni. Efni sem ekki eru náttúrulega eins og loftsteinar eða þau sem framleidd eru á rannsóknarstofu geta haft mismunandi samsætuhlutföll og því er meðalmassatóm einnig mismunandi.
Viðvörun
- Massa atóm eru alltaf skrifuð í lotueiningum (amu eða u), stundum kölluð dalton (Da). Aldrei skrifa aðra massaeiningu (eins og kíló) eftir þessa tölu án þess að breyta henni.
Það sem þú þarft
- Blýantur
- Pappír
- Fartölva
- Gögn um lifunarhlutfall samsætna í náttúrunni.
- Massagreiningareiningareining fyrir samsætur.