Höfundur:
Joan Hall
Sköpunardag:
28 Febrúar 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
- Skref
- Aðferð 1 af 3: Finna atómmassa með því að nota lotukerfi frumefna
- Aðferð 2 af 3: Útreikningur á atómmassa eins atóms
- Aðferð 3 af 3: Útreikningur á hlutfallslegum atómmassa (atómþyngd) frumefnis
- Ábendingar
- Hvað vantar þig
Frumeindamassi er summan af massa allra róteinda, nifteinda og rafeinda sem mynda þetta eða hitt atómið eða sameindina. Í samanburði við róteindir og nifteindir er massi rafeinda mjög lítill og því er ekki tekið tillit til þess í útreikningunum. Þó að þetta sé rangt frá formlegu sjónarmiði, er þetta hugtak oft notað til að vísa til meðal atómmassa allra samsætna frumefnis. Í raun er þetta hlutfallslegur atómmassi, einnig kallaður atómþyngd þáttur. Atómþyngd er meðaltal atómmassa allra náttúrulegra samsætna frumefnis. Efnafræðingar verða að gera greinarmun á þessum tveimur gerðum atómmassa þegar þeir vinna störf sín - rangt atómmassagildi getur til dæmis leitt til rangrar niðurstöðu fyrir ávöxtun hvarfafurðar.
Skref
Aðferð 1 af 3: Finna atómmassa með því að nota lotukerfi frumefna
 1 Lærðu hvernig atómmassi er skrifaður. Atómmassi, það er massi tiltekins atóms eða sameindar, er hægt að tjá í staðlaða SI einingum - grömm, kílógrömm o.s.frv. Vegna þess að atómmassinn sem gefinn er upp í þessum einingum er afar lítill, þá er hann oft skráður í sameinaðar atómmassaeiningar, eða skammstafað amu. - atómmassaeiningar. Ein atómmassaeining er jöfn 1/12 af massa staðlaðrar samsætu kolefnis-12.
1 Lærðu hvernig atómmassi er skrifaður. Atómmassi, það er massi tiltekins atóms eða sameindar, er hægt að tjá í staðlaða SI einingum - grömm, kílógrömm o.s.frv. Vegna þess að atómmassinn sem gefinn er upp í þessum einingum er afar lítill, þá er hann oft skráður í sameinaðar atómmassaeiningar, eða skammstafað amu. - atómmassaeiningar. Ein atómmassaeining er jöfn 1/12 af massa staðlaðrar samsætu kolefnis-12. - Atómmassaeiningin einkennir massann einn mól af tilteknu frumefni í grömmum... Þetta gildi er mjög gagnlegt við hagnýta útreikninga, þar sem það er hægt að nota til að auðveldlega breyta massa tiltekins fjölda atóma eða sameinda tiltekins efnis í mól, og öfugt.
 2 Finndu atómmassa í lotukerfinu. Flest staðlaða lotukerfið inniheldur atómmassa (atómþyngd) hvers frumefnis. Að jafnaði eru þau sýnd sem tala neðst í frumunni með frumefninu, undir bókstöfunum sem tákna efnafræðilega frumefnið. Þetta er venjulega ekki heil tala, heldur aukastafabrot.
2 Finndu atómmassa í lotukerfinu. Flest staðlaða lotukerfið inniheldur atómmassa (atómþyngd) hvers frumefnis. Að jafnaði eru þau sýnd sem tala neðst í frumunni með frumefninu, undir bókstöfunum sem tákna efnafræðilega frumefnið. Þetta er venjulega ekki heil tala, heldur aukastafabrot. - Athugið að öll hlutfallsleg atómmassi sem gefinn er upp í lotukerfinu fyrir hvert frumefni er meðaltal gildi. Efnafræðilegir þættir hafa mismunandi samsætur - efnafræðilegar tegundir sem hafa mismunandi massa vegna viðbótar eða vantar nifteinda í atómkjarnanum. Þess vegna er hægt að nota hlutfallslega atómmassa sem skráðir eru í lotukerfinu sem meðaltal fyrir atóm tiltekins frumefnis, en ekki sem massa eins atóms tiltekins frumefnis.
- Hlutfallsleg atómmassi sem gefinn er upp í lotukerfinu er notaður til að reikna út mólmassa atóma og sameinda. Atómmassar gefnir upp í amu (eins og í lotukerfinu) eru í grundvallaratriðum víddarlaus. Hins vegar, einfaldlega með því að margfalda atómmassann með 1 g / mól, fáum við gagnlegt einkenni frumefnis - massa (í grömmum) eins mól frumeinda þessa frumefnis.
 3 Mundu að lotukerfið skráir meðaltal atómmassa frumefnanna. Eins og áður hefur komið fram eru hlutfallsleg atómmassar sem tilgreindir eru fyrir hvert frumefni í lotukerfinu meðaltal massa allra samsætna í atómi. Þetta meðaltal er dýrmætt í mörgum hagnýtum tilgangi: til dæmis er það notað til að reikna út mólmassa sameinda sem samanstanda af nokkrum atómum. Hins vegar, þegar þú ert að fást við einstök atóm, er þetta gildi venjulega ekki nóg.
3 Mundu að lotukerfið skráir meðaltal atómmassa frumefnanna. Eins og áður hefur komið fram eru hlutfallsleg atómmassar sem tilgreindir eru fyrir hvert frumefni í lotukerfinu meðaltal massa allra samsætna í atómi. Þetta meðaltal er dýrmætt í mörgum hagnýtum tilgangi: til dæmis er það notað til að reikna út mólmassa sameinda sem samanstanda af nokkrum atómum. Hins vegar, þegar þú ert að fást við einstök atóm, er þetta gildi venjulega ekki nóg. - Þar sem meðal atómmassi er meðalgildi fyrir nokkrar samsætur, þá er gildið sem gefið er upp í lotukerfinu ekki nákvæm gildi atómmassa hvers einasta atóms.
- Reikna verður atómmassa einstakra atóma með hliðsjón af nákvæmum fjölda róteinda og nifteinda í einu atómi.
Aðferð 2 af 3: Útreikningur á atómmassa eins atóms
 1 Finndu atómtölu tiltekins frumefnis eða samsætu þess. Atómtalan er fjöldi róteinda í atómum frumefnis, hún breytist aldrei. Til dæmis öll vetnisatóm, og aðeins þeir hafa eina róteind. Atómafjöldi natríums er 11, vegna þess að kjarni hennar hefur ellefu róteindir, en atómafjöldi súrefnis er átta, þar sem kjarni hennar hefur átta róteindir. Þú getur fundið lotukerfi hvers frumefnis í lotukerfi Mendeleevs - í næstum öllum stöðluðum útgáfum þess er þessi tala tilgreind fyrir ofan bókstafstrangun efnaþáttarins. Atómtalan er alltaf jákvæð heil tala.
1 Finndu atómtölu tiltekins frumefnis eða samsætu þess. Atómtalan er fjöldi róteinda í atómum frumefnis, hún breytist aldrei. Til dæmis öll vetnisatóm, og aðeins þeir hafa eina róteind. Atómafjöldi natríums er 11, vegna þess að kjarni hennar hefur ellefu róteindir, en atómafjöldi súrefnis er átta, þar sem kjarni hennar hefur átta róteindir. Þú getur fundið lotukerfi hvers frumefnis í lotukerfi Mendeleevs - í næstum öllum stöðluðum útgáfum þess er þessi tala tilgreind fyrir ofan bókstafstrangun efnaþáttarins. Atómtalan er alltaf jákvæð heil tala. - Segjum sem svo að við höfum áhuga á kolefnisatómi. Það eru alltaf sex róteindir í kolefnisatómum, þannig að við vitum að atómtala hennar er 6. Að auki sjáum við að í lotukerfinu, í efri hluta frumunnar með kolefni (C) er talan "6", sem gefur til kynna að atómkolefnatalið sé sex.
- Athugið að lotukerfi frumefnis er ekki á einstakan hátt tengt hlutfallslegum atómmassa þess í lotukerfinu. Þó að sérstaklega fyrir frumefnin efst í töflunni gæti það litið út fyrir að atómmassi frumefnis sé tvöfalt atómafjöldi þess, hann er aldrei reiknaður með því að margfalda atómtöluna með tveimur.
 2 Finndu fjölda nifteinda í kjarnanum. Fjöldi nifteinda getur verið mismunandi fyrir mismunandi atóm sama frumefnis. Þegar tvö atóm sama frumefnis með sama fjölda róteinda hafa mismunandi fjölda nifteinda eru þær mismunandi samsætur þess frumefnis.Ólíkt fjölda róteinda, sem breytast aldrei, getur fjöldi nifteinda í atómum tiltekins frumefnis oft breyst, þannig að meðal atómmassi frumefnis er skrifaður sem aukastafsbrot með gildi sem liggur á milli tveggja samliggjandi heiltala.
2 Finndu fjölda nifteinda í kjarnanum. Fjöldi nifteinda getur verið mismunandi fyrir mismunandi atóm sama frumefnis. Þegar tvö atóm sama frumefnis með sama fjölda róteinda hafa mismunandi fjölda nifteinda eru þær mismunandi samsætur þess frumefnis.Ólíkt fjölda róteinda, sem breytast aldrei, getur fjöldi nifteinda í atómum tiltekins frumefnis oft breyst, þannig að meðal atómmassi frumefnis er skrifaður sem aukastafsbrot með gildi sem liggur á milli tveggja samliggjandi heiltala. - Hægt er að ákvarða fjölda nifteinda með tilnefningu samsætu frumefnisins. Til dæmis er kolefni-14 náttúrulega geislavirk samsæta kolefnis-12. Oft er samsætutalan tilgreind sem yfirskriftartala fyrir framan frumstáknið: C. Fjöldi nifteinda er fundinn með því að draga fjölda róteinda frá samsætutölunni: 14 - 6 = 8 nifteindir.
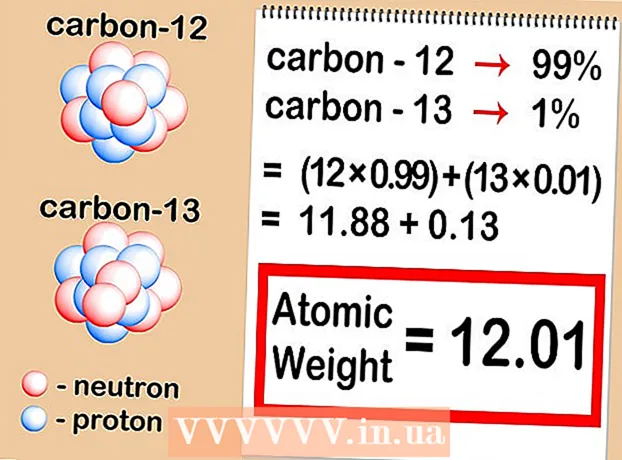
- Segjum að kolefnisatómið sem hefur áhuga hafi sex nifteindir (C). Það er algengasta samsætan kolefnis og stendur fyrir um 99% allra atóma þessa frumefnis. Hins vegar er um 1% kolefnisatóma með 7 nifteindir (C). Aðrar gerðir kolefnisatóma hafa meira en 7 eða færri en 6 nifteindir og eru til í mjög litlu magni.
 3 Leggðu saman fjölda róteinda og nifteinda. Þetta mun vera atómmassi tiltekins atóms. Hunsaðu fjölda rafeinda sem umlykja kjarnann - heildarmassi þeirra er afar lítill, þannig að þeir hafa nánast ekki áhrif á útreikninga þína.
3 Leggðu saman fjölda róteinda og nifteinda. Þetta mun vera atómmassi tiltekins atóms. Hunsaðu fjölda rafeinda sem umlykja kjarnann - heildarmassi þeirra er afar lítill, þannig að þeir hafa nánast ekki áhrif á útreikninga þína. - Kolefnisatóm okkar hefur 6 róteindir + 6 nifteindir = 12. Þannig er atómmassi þessa kolefnisatóms 12. Ef þetta væri samsætan „kolefni-13“, þá myndum við vita að það hefur 6 róteindir + 7 nifteindir = atómþyngd 13.
- Í raun er atómmassi kolefnis-13 13.003355 og þetta gildi er nákvæmara þar sem það var ákvarðað með tilraunum.
- Atómmassinn er mjög nálægt samsætutölunni. Til að auðvelda útreikninga er oft talið að samsætutala sé jöfn atómmassanum. Gildi atómmassans sem er tilrauna ákveðin fara örlítið yfir samsætutölu vegna mjög lítils framlags frá rafeindunum.
Aðferð 3 af 3: Útreikningur á hlutfallslegum atómmassa (atómþyngd) frumefnis
 1 Ákveðið hvaða samsætur eru í sýninu. Efnafræðingar ákvarða oft hlutfall samsætna í tilteknu sýni með því að nota sérstakt tæki sem kallast massagreini. Hins vegar, meðan á þjálfun stendur, verða þessar upplýsingar veittar þér við skilyrði verkefna, eftirlits og svo framvegis í formi gilda sem eru fengnar úr vísindalegum bókmenntum.
1 Ákveðið hvaða samsætur eru í sýninu. Efnafræðingar ákvarða oft hlutfall samsætna í tilteknu sýni með því að nota sérstakt tæki sem kallast massagreini. Hins vegar, meðan á þjálfun stendur, verða þessar upplýsingar veittar þér við skilyrði verkefna, eftirlits og svo framvegis í formi gilda sem eru fengnar úr vísindalegum bókmenntum. - Í okkar tilfelli, segjum að við séum að fást við tvær samsætur: kolefni-12 og kolefni-13.
 2 Ákveðið hlutfallslegt innihald hverrar samsætu í sýninu. Fyrir hvert frumefni koma mismunandi samsætur fyrir í mismunandi hlutföllum. Þessi hlutföll eru næstum alltaf gefin upp sem prósentur. Sumar samsætur eru mjög algengar en aðrar mjög sjaldgæfar - stundum svo erfiðar að greina þær. Hægt er að ákvarða þetta magn með massagreiningu eða finna í handbók.
2 Ákveðið hlutfallslegt innihald hverrar samsætu í sýninu. Fyrir hvert frumefni koma mismunandi samsætur fyrir í mismunandi hlutföllum. Þessi hlutföll eru næstum alltaf gefin upp sem prósentur. Sumar samsætur eru mjög algengar en aðrar mjög sjaldgæfar - stundum svo erfiðar að greina þær. Hægt er að ákvarða þetta magn með massagreiningu eða finna í handbók. - Segjum að styrkur kolefnis-12 sé 99%og kolefni-13 sé 1%. Aðrar samsætur kolefnis í alvöru eru til, en í svo litlu magni að í þessu tilfelli er hægt að vanrækja þær.
 3 Margfaldaðu atómmassa hverrar samsætu með styrk þess í sýninu. Margfaldaðu atómmassa hverrar samsætu með hlutfalli hennar (gefið upp sem aukastafshlutfall). Til að breyta prósentum í aukastafi, deiltu einfaldlega með 100. Styrkurinn sem myndast ætti alltaf að vera allt að 1.
3 Margfaldaðu atómmassa hverrar samsætu með styrk þess í sýninu. Margfaldaðu atómmassa hverrar samsætu með hlutfalli hennar (gefið upp sem aukastafshlutfall). Til að breyta prósentum í aukastafi, deiltu einfaldlega með 100. Styrkurinn sem myndast ætti alltaf að vera allt að 1. - Úrtakið okkar inniheldur kolefni-12 og kolefni-13. Ef kolefni-12 er 99% af sýninu og kolefni-13 er 1%, þá er nauðsynlegt að margfalda 12 (atómmassa kolefnis-12) með 0,99 og 13 (atómmassi kolefnis-13) með 0,01.
- Tilvísunarbækurnar gefa prósentur miðað við þekkt magn allra samsætna frumefnis. Flest efnafræðibækur innihalda þessar upplýsingar í töfluformi í lok bókarinnar. Fyrir sýnið sem er til rannsóknar er einnig hægt að ákvarða hlutfallslegan styrk samsætna með massagreini.
 4 Leggið niðurstöðurnar saman. Taktu saman margföldunarniðurstöður sem þú fékkst í fyrra skrefi.Sem afleiðing af þessari aðgerð finnur þú hlutfallslegan atómmassa frumefnis þíns - meðalgildi atómmassa samsætna frumefnisins sem um ræðir. Þegar litið er á frumefni í heild, frekar en tiltekna samsætu tiltekins frumefnis, er það þetta gildi sem er notað.
4 Leggið niðurstöðurnar saman. Taktu saman margföldunarniðurstöður sem þú fékkst í fyrra skrefi.Sem afleiðing af þessari aðgerð finnur þú hlutfallslegan atómmassa frumefnis þíns - meðalgildi atómmassa samsætna frumefnisins sem um ræðir. Þegar litið er á frumefni í heild, frekar en tiltekna samsætu tiltekins frumefnis, er það þetta gildi sem er notað. - Í dæminu okkar eru 12 x 0,99 = 11,88 fyrir kolefni-12 og 13 x 0,01 = 0,13 fyrir kolefni-13. Hlutfallslegur atómmassi í okkar tilviki er 11,88 + 0,13 = 12,01.
Ábendingar
- Sumar samsætur eru óstöðugri en aðrar: þær brotna niður í atóm frumefna með færri róteindum og nifteindum í kjarnanum og gefa frá sér agnir sem mynda atómkjarna. Slíkar samsætur eru kallaðar geislavirkar.
Hvað vantar þig
- Handbók efnafræði
- Reiknivél



