Höfundur:
Helen Garcia
Sköpunardag:
17 April. 2021
Uppfærsludagsetning:
1 Júlí 2024
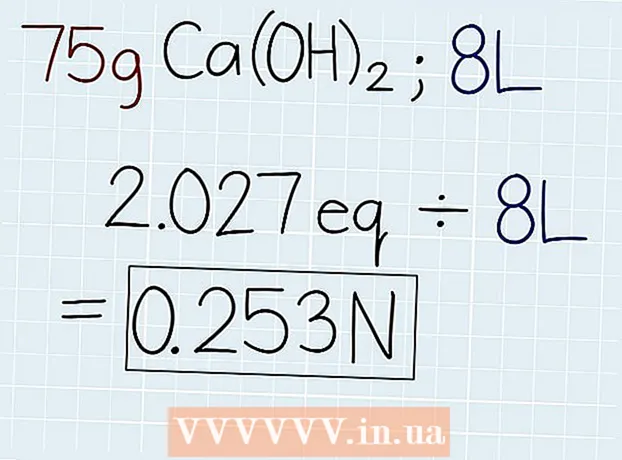
Efni.
- Skref
- Aðferð 1 af 2: Útreikningur á eðlilegu hlutfalli með Molarity
- Aðferð 2 af 2: Reikningur á eðlilegu hlutfalli í jafngildum massa
- Ábendingar
- Hvað vantar þig
Venjulegt gefur til kynna styrk sýru eða basa í lausn. Til að komast að eðlilegri lausn er hægt að nota bæði molstyrk og samsvarandi massa sameindarinnar í útreikningunum. Ef þú velur að nota molstyrk, notaðu þá formúluna N = M (n), þar sem M er molstyrkur og n er fjöldi vetnis eða hýdroxíðsameinda. Ef þú ákveður að nota samsvarandi massa skaltu nota formúluna N = eq ÷ V, þar sem eq er fjöldi jafngilda og V er rúmmál lausnarinnar.
Skref
Aðferð 1 af 2: Útreikningur á eðlilegu hlutfalli með Molarity
 1 Setjið saman mólmassa allra íhluta lausnarinnar. Finndu frumefni efnaformúlunnar á lotukerfinu til að komast að atómmassa þeirra, sem samsvarar mólmassa. Skrifaðu niður mólmassa hvers frumefnis og margfaldaðu hann með fjölda þessara frumefna. Leggið saman mólmassa allra íhluta til að finna heildarmassamassann.
1 Setjið saman mólmassa allra íhluta lausnarinnar. Finndu frumefni efnaformúlunnar á lotukerfinu til að komast að atómmassa þeirra, sem samsvarar mólmassa. Skrifaðu niður mólmassa hvers frumefnis og margfaldaðu hann með fjölda þessara frumefna. Leggið saman mólmassa allra íhluta til að finna heildarmassamassann. - Til dæmis, ef þú vilt vita molamassa brennisteinssýru (H2SVO4), finndu mólmassa vetnis (1 g), brennisteins (3 g) og súrefnis (16 g).
- Margfaldaðu massann með fjölda íhluta í samsetningunni. Í dæminu okkar eru 2 vetnisatóm og 4 súrefnisatóm. Heildarmassamassi vetnis er 2 x 1 g = 2 g. Mólmassi súrefnis í þessari lausn verður 4 x 16 g = 64 g.
- Bætið öllum molamassa saman við. Þú færð 2 g + 32 g + 64 g = 98 g / mól.
- Ef þú veist nú þegar hversu mikið lausnin er sem þú ert að leita að skaltu fara beint í skref 4.
 2 Deildu raunverulegum massa lausnarinnar með mólmassa. Finndu út raunverulega þyngd lausnarinnar. Það verður annaðhvort tilgreint á ílátinu með lausninni eða í verkefninu sjálfu.Skiptu síðan massa lausnarinnar með heildar molamassanum sem fannst fyrr. Niðurstaðan verður fjöldi mól í lausninni, en síðan skal skrifa „mól“.
2 Deildu raunverulegum massa lausnarinnar með mólmassa. Finndu út raunverulega þyngd lausnarinnar. Það verður annaðhvort tilgreint á ílátinu með lausninni eða í verkefninu sjálfu.Skiptu síðan massa lausnarinnar með heildar molamassanum sem fannst fyrr. Niðurstaðan verður fjöldi mól í lausninni, en síðan skal skrifa „mól“. - Til dæmis, ef þú ert að reyna að komast að eðlilegu 100 g H2SVO4leyst upp í 12 lítra af vökva, notaðu raunverulegan massa og deildu með mól. Þar af leiðandi færðu: 100 g ÷ 98 g / mol = 1,02 mol.
- 1 mól er jafnt 6,02 x 10 atóm eða sameindir lausnar.
 3 Skiptið niðurstöðunni með rúmmáli lausnarinnar í lítrum til að komast að molagildi. Taktu fjölda mól í lausninni sem var nýlega reiknuð og deildu henni með heildarrúmmáli lausnarinnar sem á að mæla. Þar af leiðandi muntu þekkja molstyrk (M), sem þú getur fundið út styrk lausnarinnar.
3 Skiptið niðurstöðunni með rúmmáli lausnarinnar í lítrum til að komast að molagildi. Taktu fjölda mól í lausninni sem var nýlega reiknuð og deildu henni með heildarrúmmáli lausnarinnar sem á að mæla. Þar af leiðandi muntu þekkja molstyrk (M), sem þú getur fundið út styrk lausnarinnar. - Byggt á dæmi okkar fáum við eftirfarandi formúlu: 1,02 mól ÷ 12 L = 0,085 M.
Ráð: vertu viss um að breyta rúmmáli lausnarinnar í lítra, ef þú hefur ekki þegar gert það. Annars færðu rangt svar.
 4 Margfalda molstyrk með fjölda vetnis eða hýdroxíðsameinda. Skoðaðu efnaformúluna til að finna út fjölda vetnisatóma (H) í sýru eða hýdroxíðsameindum í (OH) í grunninum. Margfaldaðu síðan mólstyrk lausnarinnar með fjölda vetnis eða hýdroxíðsameinda í þeirri lausn til að finna eðlilega styrk eða eðlilegleika. Í lok svarsins skaltu skrifa skammstöfunina "N".
4 Margfalda molstyrk með fjölda vetnis eða hýdroxíðsameinda. Skoðaðu efnaformúluna til að finna út fjölda vetnisatóma (H) í sýru eða hýdroxíðsameindum í (OH) í grunninum. Margfaldaðu síðan mólstyrk lausnarinnar með fjölda vetnis eða hýdroxíðsameinda í þeirri lausn til að finna eðlilega styrk eða eðlilegleika. Í lok svarsins skaltu skrifa skammstöfunina "N". - Í dæminu okkar er brennisteinssýra (H2SVO4) 2 vetnisatóm. Þannig að formúlan verður svona: 0,085 M x 2 = 0,17 N.
- Í öðru dæmi hefur natríumhýdroxíð (NaOH) með einmagni 2 M aðeins 1 hýdroxíðsameind. Þess vegna verður formúlan sem hér segir: 2 M x 1 = 2 N.
Aðferð 2 af 2: Reikningur á eðlilegu hlutfalli í jafngildum massa
 1 Finndu út heildarmassamassa lausnarinnar. Skoðaðu efnaformúlu lausnarinnar og finndu hvert frumefni á lotukerfinu. Skrifaðu niður mólmassa hvers frumefnis og margfaldaðu hann með fjölda þessara frumefna í formúlunni. Bætið öllum mólmassa saman til að finna heildarmassamassann í grömmum.
1 Finndu út heildarmassamassa lausnarinnar. Skoðaðu efnaformúlu lausnarinnar og finndu hvert frumefni á lotukerfinu. Skrifaðu niður mólmassa hvers frumefnis og margfaldaðu hann með fjölda þessara frumefna í formúlunni. Bætið öllum mólmassa saman til að finna heildarmassamassann í grömmum. - Til dæmis, ef þú vilt vita mólmassa Ca (OH)2, finndu síðan mólmassa kalsíums (40 g), súrefnis (16 g) og vetnis (1 g).
- Í formúlunni eru 2 atóm súrefnis og vetnis. Heildarmassi súrefnis verður: 2 x 16 g = 32 g. Mólmassi vetnis verður: 2 x 1 g = 2 g.
- Bætið öllum mólmassa saman til að fá 40 g + 32 g + 2 g = 74 g / mól.
 2 Deildu mólmassa með fjölda vetnis eða hýdroxíðsameinda. Finndu fjölda vetnisatóma (H) í sýru eða hýdroxíð (OH) sameindum í grunninum. Skiptu heildarmassamassanum sem er bara fenginn með fjölda atóma eða sameinda til að finna þyngd 1 jafngildis, sem verður jöfn massa 1 mól af vetni eða hýdroxíði. Í lok svara skal skrifa skammstöfunina "G.-e" sem þýðir massa samsvarandi.
2 Deildu mólmassa með fjölda vetnis eða hýdroxíðsameinda. Finndu fjölda vetnisatóma (H) í sýru eða hýdroxíð (OH) sameindum í grunninum. Skiptu heildarmassamassanum sem er bara fenginn með fjölda atóma eða sameinda til að finna þyngd 1 jafngildis, sem verður jöfn massa 1 mól af vetni eða hýdroxíði. Í lok svara skal skrifa skammstöfunina "G.-e" sem þýðir massa samsvarandi. - Í dæminu okkar, Ca (OH)2 2 tvær vetnisameindir, sem þýðir að massi jafngildisins verður jöfn 74 g / mól ÷ 2 = 37 G.-e.
 3 Deildu raunverulegri þyngd lausnarinnar með samsvarandi þyngd. Eftir að þú veist massa samsvarandi, deildu því með massa lausnarinnar, sem er tilgreint á ílátinu með lausninni eða í vandamálinu sem er leyst. Svarið verður fjöldi jafngilda í lausninni þannig að þú getur síðan reiknað út eðlilegleika. Í lok svara skal setja skammstöfunina "e."
3 Deildu raunverulegri þyngd lausnarinnar með samsvarandi þyngd. Eftir að þú veist massa samsvarandi, deildu því með massa lausnarinnar, sem er tilgreint á ílátinu með lausninni eða í vandamálinu sem er leyst. Svarið verður fjöldi jafngilda í lausninni þannig að þú getur síðan reiknað út eðlilegleika. Í lok svara skal setja skammstöfunina "e." - Ef í dæminu okkar er 75 g Ca (OH)2, þá verður formúlan eftirfarandi: 75 g ÷ 37 G.-e = 2.027 Oe.
 4 Skiptu fjölda jafngilda með rúmmáli lausnar í lítrum. Finndu út heildarrúmmál lausnarinnar og skrifaðu niður svarið í lítrum. Taktu fjölda jafngilda sem þú hefur fengið og deildu með rúmmáli lausnarinnar til að komast að eðlilegu ástandi. Í lok svars þíns seturðu skammstöfun "N".
4 Skiptu fjölda jafngilda með rúmmáli lausnar í lítrum. Finndu út heildarrúmmál lausnarinnar og skrifaðu niður svarið í lítrum. Taktu fjölda jafngilda sem þú hefur fengið og deildu með rúmmáli lausnarinnar til að komast að eðlilegu ástandi. Í lok svars þíns seturðu skammstöfun "N". - Ef það er 75 g Ca (OH) í lausn með 8 lítra rúmmáli2, deildu síðan fjölda jafngilda með rúmmálinu á eftirfarandi hátt: 2.027 Oe. ÷ 8 l = 0,253 N.
Ábendingar
- Venjulegur styrkur, eða venjuleiki, er almennt notaður til að mæla sýrur og basa. Ef þú þarft að ákvarða styrk annars lausnar, er þetta venjulega gert með því að mæla einleikann.
Hvað vantar þig
- Lotukerfið
- Reiknivél