Höfundur:
Christy White
Sköpunardag:
8 Maint. 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
- Að stíga
- Aðferð 1 af 3: Fyrsti hluti: Skilningur á rafeindaskeljum
- Aðferð 2 af 3: Hluti tvö: Að finna gildisrafeindir í málmum, nema skiptimálmar
- Aðferð 3 af 3: Þriðji hluti: Að finna gildisrafeindir í umbreytimálmum
- Ábendingar
- Nauðsynjar
Gildisrafeindir liggja í ytri skel frumefnis. Fjöldi gildisrafeinda í atómi ákvarðar tegund efnatengingar sem þetta frumefni getur myndað. Besta leiðin til að komast að fjölda gildisrafeinda er að nota lotukerfi frumefnanna.
Að stíga
Aðferð 1 af 3: Fyrsti hluti: Skilningur á rafeindaskeljum
 Periodic Table of the Elements. Þetta er tafla með litakóða, þar sem frumefni birtist með lotu númerinu og 1 til 3 bókstöfum sem tákn.
Periodic Table of the Elements. Þetta er tafla með litakóða, þar sem frumefni birtist með lotu númerinu og 1 til 3 bókstöfum sem tákn.  Finndu atómtölu frumefnisins. Atómtölan er fyrir ofan eða við hliðina á tákn frumefnisins. Til dæmis: Bor (B) hefur atómtöluna 5, sem þýðir að það hefur 5 róteindir og 5 rafeindir.
Finndu atómtölu frumefnisins. Atómtölan er fyrir ofan eða við hliðina á tákn frumefnisins. Til dæmis: Bor (B) hefur atómtöluna 5, sem þýðir að það hefur 5 róteindir og 5 rafeindir.  Teiknaðu einfalda framsetningu atóms og settu rafeindirnar á braut um kjarnann. Þessi störf eru einnig kölluð skeljar eða orkustig. Hámarksfjöldi rafeinda sem geta verið í sömu skel er fastur og skeljarnar fyllast frá innri til ytri brautar.
Teiknaðu einfalda framsetningu atóms og settu rafeindirnar á braut um kjarnann. Þessi störf eru einnig kölluð skeljar eða orkustig. Hámarksfjöldi rafeinda sem geta verið í sömu skel er fastur og skeljarnar fyllast frá innri til ytri brautar. - K Skel (innri): 2 rafeindir að hámarki.
- L Skel: 8 rafeindir að hámarki.
- M Skel: 18 rafeindir að hámarki.
- N Skel: 32 rafeindir að hámarki.
- O Skel: 50 rafeindir að hámarki.
- P Skel (ytri): 72 rafeindir að hámarki.
 Finndu fjölda rafeinda í ytri skelinni. Þetta eru gildisrafeindir.
Finndu fjölda rafeinda í ytri skelinni. Þetta eru gildisrafeindir. - Þegar gildisskelin er full er frumefnið stöðugt.
- Ef gildisskelin er ekki full þá er frumefnið hvarfgjarnt sem þýðir að það getur efnafræðilega tengst atómi annars frumefnis. Hvert atóm deilir rafeindum sínum til að reyna að gera gildisskelina fulla.
Aðferð 2 af 3: Hluti tvö: Að finna gildisrafeindir í málmum, nema skiptimálmar
 Talið hvern dálk reglulegu töflu, frá 1 til 18. Vetni (H) er efst í dálki 1 og Helium (He) efst í dálki 18. Þetta eru mismunandi frumefnahópar.
Talið hvern dálk reglulegu töflu, frá 1 til 18. Vetni (H) er efst í dálki 1 og Helium (He) efst í dálki 18. Þetta eru mismunandi frumefnahópar.  Gefðu hverri röð tölu, frá 1 til 7. Þetta eru tímabil frumefnanna og þau samsvara fjölda skelja eða orkustigs atóms.
Gefðu hverri röð tölu, frá 1 til 7. Þetta eru tímabil frumefnanna og þau samsvara fjölda skelja eða orkustigs atóms. - Vetni (H) og Helium (He) hafa bæði 1 skel en Francium (Fr) 7.
- Lanthaníðin og aktíníðin eru flokkuð og skráð fyrir neðan aðalborðið. Öll lanthaníð tilheyra tímabili 6, hópi 3 og öll aktíníð tilheyra tímabili 7, hópi 3.
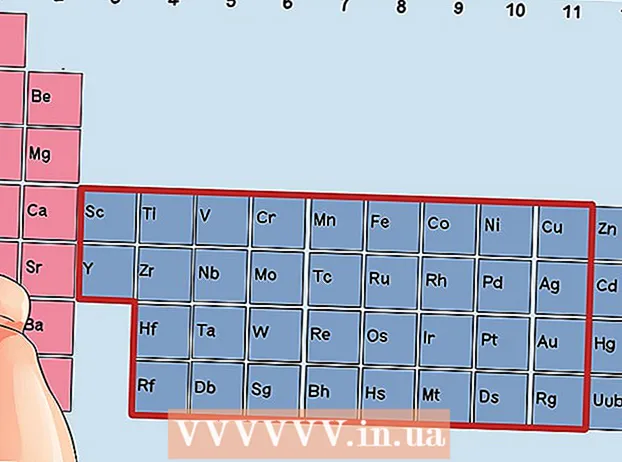
 Finndu frumefni sem er ekki umbreytingarmálmur. Umbreytingarmálmar eru í hópum 3 til 12. Hópnúmer annarra málma gefa til kynna fjölda gildisrafeinda.
Finndu frumefni sem er ekki umbreytingarmálmur. Umbreytingarmálmar eru í hópum 3 til 12. Hópnúmer annarra málma gefa til kynna fjölda gildisrafeinda. - Hópur 1: 1 gildi rafeind
- Hópur 2: 2 gildisrafeindir
- Hópur 13: 3 gildisrafeindir
- Hópur 14: 4 gildisrafeindir
- Hópur 15: 5 gildisrafeindir
- Hópur 16: 6 gildisrafeindir
- Hópur 17: 7 gildisrafeindir
- Hópur 18: 8 gildisrafeindir - nema Helium, sem hefur 2
Aðferð 3 af 3: Þriðji hluti: Að finna gildisrafeindir í umbreytimálmum
 Finndu frumefni úr hópum 3 til 12, umskiptimálma.
Finndu frumefni úr hópum 3 til 12, umskiptimálma. Finndu fjölda gildisrafeinda út frá hópnúmerinu. Þessar hópatölur samsvara mögulegum fjölda gildisrafeinda.
Finndu fjölda gildisrafeinda út frá hópnúmerinu. Þessar hópatölur samsvara mögulegum fjölda gildisrafeinda. - Hópur 3: 3 gildisrafeindir
- Hópur 4: 2 til 4 gildisrafeindir
- Hópur 5: 2 til 5 gildisrafeindir
- Hópur 6: 2 til 6 gildisrafeindir
- Hópur 7: 2 til 7 gildisrafeindir
- Hópur 8: 2 eða 3 gildisrafeindir
- Hópur 9: 2 eða 3 gildisrafeindir
- Hópur 10: 2 eða 3 gildisrafeindir
- Hópur 11: 1 eða 2 gildisrafeindir
- Hópur 12: 2 gildisrafeindir
Ábendingar
- Umbreytingarmálmar geta haft gildisskeljar sem eru ekki alveg fullar. Til að ákvarða nákvæman fjölda gildisrafeinda í umskiptimálmum þarf ákveðin meginreglur skammtafræðinnar sem eru utan gildissviðs þessarar greinar.
Nauðsynjar
- Regluborð yfir frumefnin
- Blýantur
- Pappír