Höfundur:
Frank Hunt
Sköpunardag:
16 Mars 2021
Uppfærsludagsetning:
27 Júní 2024
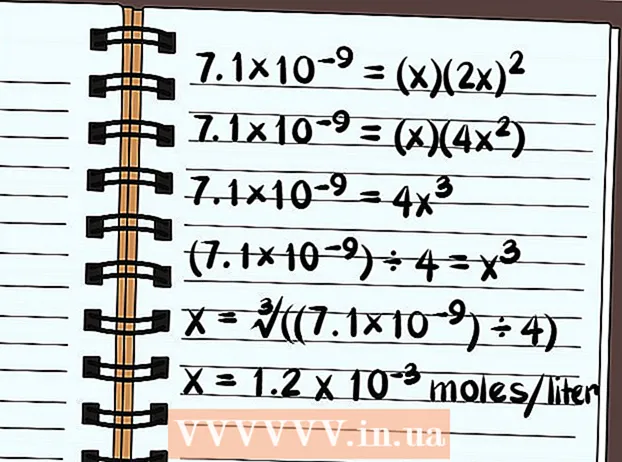
Efni.
- Að stíga
- Aðferð 1 af 2: Notaðu skyndireglur
- Aðferð 2 af 2: Útreikningur á leysni K.sp
- Nauðsynjar
- Ábendingar
- Viðvaranir
Í efnafræði er leysanleiki notaður til að lýsa eiginleikum fasts efnis sem blandað er saman við og leysist upp í vökva, án þess að skilja eftir óuppleystar agnir. Aðeins (hlaðin) jónísk efnasambönd eru leysanleg. Í hagnýtum tilgangi er nóg að leggja nokkrar reglur á minnið eða hafa samráð við lista yfir reglur til að segja þér til um hvort flest jónísk efnasambönd haldast föst þegar þau eru blandað við vatn eða hvort verulegt magn leysist upp. Í raun og veru munu sumar sameindir leysast upp þó þú sjáir engar breytingar, svo að fyrir nákvæmar tilraunir þarftu að vita hvernig á að reikna þessa upphæð.
Að stíga
Aðferð 1 af 2: Notaðu skyndireglur
 Vita meira um jónasambönd. Hvert atóm hefur venjulega fjölda rafeinda, en stundum öðlast þeir eða missa eina rafeind til viðbótar. Niðurstaðan er ein jón með rafhleðslu. Þegar jóna með neikvæða hleðslu (auka rafeind) mætir jón með jákvæðu hleðslu (rafeind vantar) tengjast þau saman, rétt eins og neikvæðir og jákvæðir endar tveggja segla. Niðurstaðan er jónatengi.
Vita meira um jónasambönd. Hvert atóm hefur venjulega fjölda rafeinda, en stundum öðlast þeir eða missa eina rafeind til viðbótar. Niðurstaðan er ein jón með rafhleðslu. Þegar jóna með neikvæða hleðslu (auka rafeind) mætir jón með jákvæðu hleðslu (rafeind vantar) tengjast þau saman, rétt eins og neikvæðir og jákvæðir endar tveggja segla. Niðurstaðan er jónatengi. - Jónar með neikvæða hleðslu eru kallaðir anjónur, og jónir með jákvæða hleðslu katjónir.
- Venjulega er fjöldi rafeinda í atómi jafn fjöldi róteinda, þar sem rafhleðslurnar eru í jafnvægi.
 Vita leysni. Vatnssameindir (H.2O) hafa óvenjulega uppbyggingu, sem þeir haga sér eins og segull: annar endinn hefur jákvæða hleðslu en hinn endinn er neikvætt hlaðinn. Þegar þú blandar jónatengi við vatn safnast þessi „vatnssegull“ í kringum það og reynir að draga jákvæðu og neikvæðu jónirnar í sundur. Sum jónatengi eru ekki mjög þétt saman; þetta eru leysanlegtvegna þess að vatn rífur og leysir upp tengið. Önnur samsett efni hafa sterkari bönd og eru Ekki leysanlegtvegna þess að þeir geta haldið sig saman þrátt fyrir vatnssameindirnar.
Vita leysni. Vatnssameindir (H.2O) hafa óvenjulega uppbyggingu, sem þeir haga sér eins og segull: annar endinn hefur jákvæða hleðslu en hinn endinn er neikvætt hlaðinn. Þegar þú blandar jónatengi við vatn safnast þessi „vatnssegull“ í kringum það og reynir að draga jákvæðu og neikvæðu jónirnar í sundur. Sum jónatengi eru ekki mjög þétt saman; þetta eru leysanlegtvegna þess að vatn rífur og leysir upp tengið. Önnur samsett efni hafa sterkari bönd og eru Ekki leysanlegtvegna þess að þeir geta haldið sig saman þrátt fyrir vatnssameindirnar. - Sumar tengingar hafa innri tengi sem eru sambærileg að styrkleika og vatnsdrátturinn. Þessi efni eru miðlungs leysanlegt, vegna þess að verulegur hluti (en ekki allir) skuldabréfanna verður dreginn í sundur.
 Lærðu reglur um leysni. Þar sem samspil frumeinda er nokkuð flókið er ekki alltaf leiðandi hvaða efnasambönd eru leysanleg og óleysanleg. Finndu fyrstu jónina í efnasambandinu í listanum hér að neðan til að komast að því hvernig hún hegðar sér venjulega og athugaðu síðan undantekningarnar til að ganga úr skugga um að önnur jónin hafi ekki óeðlileg samskipti.
Lærðu reglur um leysni. Þar sem samspil frumeinda er nokkuð flókið er ekki alltaf leiðandi hvaða efnasambönd eru leysanleg og óleysanleg. Finndu fyrstu jónina í efnasambandinu í listanum hér að neðan til að komast að því hvernig hún hegðar sér venjulega og athugaðu síðan undantekningarnar til að ganga úr skugga um að önnur jónin hafi ekki óeðlileg samskipti. - Til dæmis að nota strontíumklóríð (SrCl2), leitaðu að Sr eða Cl í feitletruðu skrefunum sem gefin eru upp hér að neðan. Cl er „að mestu leyst“ svo leitaðu að undantekningum hér að neðan. Sr er ekki tilgreint sem undantekning, svo SrCl2 vera leysanleg.
- Algengustu undantekningarnar frá hverri reglu eru taldar upp hér að neðan. Það eru aðrar undantekningar en líklega finnurðu þær ekki í almennum efnafræðitíma eða rannsóknarstofu.
 Efnasambönd eru leysanleg þegar þau innihalda basa málma, þar með talin Li, Na, K, Rb og Cs. Þetta eru einnig kölluð frumefni í hópi IA: litíum, natríum, kalíum, rúbídíum og cesíum. Næstum öll efnasambönd með einhverjum af þessum jónum eru leysanleg.
Efnasambönd eru leysanleg þegar þau innihalda basa málma, þar með talin Li, Na, K, Rb og Cs. Þetta eru einnig kölluð frumefni í hópi IA: litíum, natríum, kalíum, rúbídíum og cesíum. Næstum öll efnasambönd með einhverjum af þessum jónum eru leysanleg. - Undantekning: Li3PO4 er ekki leysanlegt.
 Efnasambönd með NO3, C2H.3O2, NEI2, ClO3 og ClO4 eru leysanleg. Þetta eru nítrat, asetat, nítrít, klórat og perklórat jónir. Athugið að asetat er oft skammstafað með OAc.
Efnasambönd með NO3, C2H.3O2, NEI2, ClO3 og ClO4 eru leysanleg. Þetta eru nítrat, asetat, nítrít, klórat og perklórat jónir. Athugið að asetat er oft skammstafað með OAc. - Undantekningar: Ag (OAc) (silfurasetat) og Hg (OAc)2 (kvikasilfur asetat) eru ekki leysanleg.
- AgNO2 og KClO4 eru aðeins „að hluta leysanleg“.
 efnasambönd með Cl, Br og I eru venjulega leysanleg. Klóríð-, brómíð- og joðíðjónir mynda næstum alltaf leysanleg efnasambönd, einnig þekkt sem halógen sölt.
efnasambönd með Cl, Br og I eru venjulega leysanleg. Klóríð-, brómíð- og joðíðjónir mynda næstum alltaf leysanleg efnasambönd, einnig þekkt sem halógen sölt. - Undantekning: Ef annað hvort þessara bindist við jónir silfurs (Ag), kvikasilfur (Hg2), eða blý (Pb), niðurstaðan er ekki leysanleg. Sama á við um sjaldgæfari efnasambönd með kopar (Cu) og þallíum (Tl).
 Tengingar við SO4 eru venjulega leysanleg. Súlfat jónin myndar venjulega leysanleg efnasambönd, en það eru nokkrar undantekningar.
Tengingar við SO4 eru venjulega leysanleg. Súlfat jónin myndar venjulega leysanleg efnasambönd, en það eru nokkrar undantekningar. - Undantekningar: Súlfat jónin myndar óleysanleg efnasambönd með eftirfarandi jónum: strontium Sr, barium Ba, blý Pb, silfur Ag, kalsíum Ca, radium Ra og kísilgúr Ag2. Athugaðu að silfursúlfat og kalsíumsúlfat leysast upp alveg nógu mikið til að það sé stundum kallað lítið leysanlegt.
 Efnasambönd með OH eða S eru ekki leysanleg. Þetta eru hýdroxíð- og súlfíðjónin.
Efnasambönd með OH eða S eru ekki leysanleg. Þetta eru hýdroxíð- og súlfíðjónin. - Undantekningar: Manstu eftir alkalímálmunum (hópur I-A) og hversu mikið þeir vilja mynda óleysanleg efnasambönd? Li, Na, K, Rb og Cs mynda öll leysanleg efnasambönd með hýdroxíð- eða súlfíðjónum. Að auki myndar hýdroxíð leysanleg sölt með jarðalkalíum (Group II-A) jónir: kalsíum Ca, strontium Sr og barium Ba. Athugið að hýdroxíðið með jarðalkalíusambandi hefur rétt nægar sameindir til að halda sig saman til að vera stundum álitnar „lítt leysanlegar“.
 Efnasambönd með CO3 eða PO4 eru ekki leysanleg. Athugaðu í síðasta skipti hvort karbónat- og fosfatjónir séu í boði og þú ættir að vita hverju þú getur búist við af efnasambandinu.
Efnasambönd með CO3 eða PO4 eru ekki leysanleg. Athugaðu í síðasta skipti hvort karbónat- og fosfatjónir séu í boði og þú ættir að vita hverju þú getur búist við af efnasambandinu. - Undantekningar: Þessar jónir mynda leysanleg efnasambönd með venjulegum efnum, alkalímálmunum Li, Na, K, Rb og Cs, svo og með ammoníum NH4.
Aðferð 2 af 2: Útreikningur á leysni K.sp
 Flettu upp leysanleika af föstu K.sp. Þessi fasti er mismunandi fyrir hverja tengingu, svo þú þarft að fletta því upp í töflu í kennslubókinni þinni eða á netinu. Þar sem þessi gildi eru ákvörðuð með tilraunum geta þau verið mjög mismunandi frá borði til borðs og því er best að nota töfluna í kennslubókinni, ef hún er til. Nema annað sé tekið fram gera flestar töflur ráð fyrir 25 ° C umhverfishita.
Flettu upp leysanleika af föstu K.sp. Þessi fasti er mismunandi fyrir hverja tengingu, svo þú þarft að fletta því upp í töflu í kennslubókinni þinni eða á netinu. Þar sem þessi gildi eru ákvörðuð með tilraunum geta þau verið mjög mismunandi frá borði til borðs og því er best að nota töfluna í kennslubókinni, ef hún er til. Nema annað sé tekið fram gera flestar töflur ráð fyrir 25 ° C umhverfishita. - Til dæmis, ef þú vilt leysa upp blý joðíð (PbI2), skrifaðu niður jafnvægisfasta leysanleika afurðarinnar. Ef þú ert að nota töflu á bilbo.chm.uri.edu, notaðu stöðuga 7,1 × 10.
 Skrifaðu fyrst efnajöfnuna. Fyrst skal ákvarða hvernig efnasambandið brotnar niður í jónir þegar það leysist upp. Skrifaðu nú jöfnu við K.sp annars vegar og einstakar jónir hins vegar.
Skrifaðu fyrst efnajöfnuna. Fyrst skal ákvarða hvernig efnasambandið brotnar niður í jónir þegar það leysist upp. Skrifaðu nú jöfnu við K.sp annars vegar og einstakar jónir hins vegar. - Til dæmis sameind PbI2 klofnar í jónin Pb, I og annað I (þú þarft aðeins að vita eða fletta upp hleðslu einnar jónu, því þú veist að heildarsambandið hefur alltaf hlutlausa hleðslu).
- Skrifaðu jöfnu 7.1 × 10 = [Pb] [I]
 Stilltu jöfnuna til að nota breytur. Endurskrifaðu jöfnuna sem eitt algebru vandamál, notaðu þekkingu þína á fjölda sameinda eða jóna. Stilltu x jafnt magni efnisins sem mun leysast upp og skrifaðu breyturnar aftur sem tölur hverrar jónu hvað varðar x.
Stilltu jöfnuna til að nota breytur. Endurskrifaðu jöfnuna sem eitt algebru vandamál, notaðu þekkingu þína á fjölda sameinda eða jóna. Stilltu x jafnt magni efnisins sem mun leysast upp og skrifaðu breyturnar aftur sem tölur hverrar jónu hvað varðar x. - Í dæminu okkar endurskrifum við 7,1 × 10 = [Pb] [I]
- Þar sem aðeins ein blýjón (Pb) er í efnasambandinu verður fjöldi sameinda sem eru uppleyst jafnt og fjöldi frjálsra blýjóna. Svo við getum skipt út [Pb] fyrir x.
- Þar sem það eru tvö joðjónir (I) fyrir hverja blýjón, getum við jafnað fjölda joðatóna við 2x.
- Jafnan les nú 7.1 × 10 = (x) (2x)
 Hugleiddu algengar jónir, ef einhverjar eru. Slepptu þessu skrefi ef þú ert að leysa efnasambandið upp í hreinu vatni. Hins vegar, ef efnasambandið er leyst upp í lausn sem þegar inniheldur einn eða fleiri af efnisþáttum jóna („sameiginleg jóna“), minnkar leysni verulega. Áhrif algengra jóna eru mest áberandi í efnasamböndum sem eru að mestu leyti óleysanleg og í þessum tilfellum má gera ráð fyrir að mikill meirihluti jóna við jafnvægi komi frá jóninni sem þegar er til staðar í lausninni. Endurskrifaðu jöfnuna við þekktan mólstyrk (mól á lítra eða M) jóna sem þegar eru í lausninni, í staðinn fyrir gildi x sem þú notaðir fyrir jónina.
Hugleiddu algengar jónir, ef einhverjar eru. Slepptu þessu skrefi ef þú ert að leysa efnasambandið upp í hreinu vatni. Hins vegar, ef efnasambandið er leyst upp í lausn sem þegar inniheldur einn eða fleiri af efnisþáttum jóna („sameiginleg jóna“), minnkar leysni verulega. Áhrif algengra jóna eru mest áberandi í efnasamböndum sem eru að mestu leyti óleysanleg og í þessum tilfellum má gera ráð fyrir að mikill meirihluti jóna við jafnvægi komi frá jóninni sem þegar er til staðar í lausninni. Endurskrifaðu jöfnuna við þekktan mólstyrk (mól á lítra eða M) jóna sem þegar eru í lausninni, í staðinn fyrir gildi x sem þú notaðir fyrir jónina. - Til dæmis ef blý joð efnasamband okkar var leyst upp í lausn sem innihélt 0,2 M blý klóríð (PbCl2), þá getum við endurskrifað jöfnuna sem 7,1 × 10 = (0,2M + x) (2x). Og þá, vegna þess að 0,2M er svo hærri styrkur en x, getum við örugglega endurskrifað þetta sem 7,1 × 10 = (0,2M) (2x).
 Leystu jöfnuna. Leysið fyrir x og vitið hversu leysanlegt efnasambandið er. Vegna þess hvernig leysanleikafastan er skilgreind verður svar þitt gefið upp sem fjöldi móla af uppleystu efnasambandinu á lítra af vatni. Þú gætir þurft reiknivél til að finna endanlega svarið.
Leystu jöfnuna. Leysið fyrir x og vitið hversu leysanlegt efnasambandið er. Vegna þess hvernig leysanleikafastan er skilgreind verður svar þitt gefið upp sem fjöldi móla af uppleystu efnasambandinu á lítra af vatni. Þú gætir þurft reiknivél til að finna endanlega svarið. - Eftirfarandi á við um leysni í hreinu vatni, ekki með neinum algengum jónum.
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mól á lítra leysast upp. Þetta er mjög lítið magn, svo þú veist að þetta efnasamband er í grundvallaratriðum illa leysanlegt.
Nauðsynjar
- Tafla yfir fasta fyrir leysanleikaafurðir (K.sp) fyrir tengingar.
Ábendingar
- Ef þú hefur gögn frá tilraunum um það hve mikið efnasamband er leyst upp, getur þú notað sömu jöfnu til að leysa leysanleika stöðugt Ksp.
Viðvaranir
- Engin almennt viðurkennd skilgreining er á þessum hugtökum en efnafræðingar eru sammála um meirihluta efnasambanda. Nokkrum jaðartilvikum varðandi efnasamböndin með verulegt hlutfall uppleystra og óuppleystra sameinda er hægt að lýsa með mismunandi leysitöflum.
- Sumar eldri kennslubækur gefa NH4OH aftur sem leysanleg samsetning. Þetta er rangt; lítið magn af NH4 og OH jónir má sjá, en ekki er hægt að einangra þær til að mynda efnasamband.