Höfundur:
Lewis Jackson
Sköpunardag:
5 Maint. 2021
Uppfærsludagsetning:
1 Júlí 2024

Efni.
Mol er staðlaða mælieiningin í efnafræði, notuð til að skoða mismunandi frumefni í efnasambandi. Venjulega er massi efnasambands reiknaður í grömmum (g) og þarf að breyta því í molareiningar. Umskiptin eru frekar einföld, samt eru enn nokkur mikilvæg skref sem við þurfum að fylgja. Með því að nota aðferðina hér að neðan geturðu auðveldlega umbreytt grömmum í mól.
Skref
Hluti 1 af 2: Reiknið sameindarmassa
Undirbúið nauðsynlegar birgðir til að leysa stærðfræðidæmið. Þegar þú hefur öll tækin tiltæk verður auðveldara að leysa vandamálið. Það sem þú þarft er:
- Blýantur og pappír. Stærðfræðin verður auðveldari þegar þú skrifar allt niður á blað. Þú verður að kynna öll skrefin til að ná hámarkseinkunn.
- Periodic table of chemical frumefni: notað til að ákvarða massa atóm frumefnanna.
- Vasareiknivél: notað til að reikna flóknar tölur.

Finndu hvaða frumefni eru í efnasambandinu sem þú þarft að umbreyta í molareiningar. Fyrsta skrefið við útreikning á sameindarmassa er að ákvarða frumefnin sem mynda efnasambandið. Þetta er auðvelt vegna þess að styttingin fyrir þætti er aðeins einn til tveir stafir.- Ef efni er skammstafað með tveimur bókstöfum, verður stóri stafurinn hástafi og annar stafurinn með litlum staf. Dæmi: Mg er skammstöfun frumefnisins magnesíum.
- NaHCO efnasambönd3 samanstendur af fjórum frumefnum: natríum (Na), vetni (H), kolefni (C) og súrefni (O).
Finndu fjölda atóma fyrir hvert frumefni í efnasambandinu. Þú þarft að vita lotufræðilegt númer hvers efnis í efnasambandi til að reikna út massasameind þess efnasambands. Litla talan við hliðina á skammstöfun frumefnisins táknar lotutölu frumefnisins.- Dæmi: efnasamband H2O hefur tvö vetnisatóm og eitt súrefnisatóm.
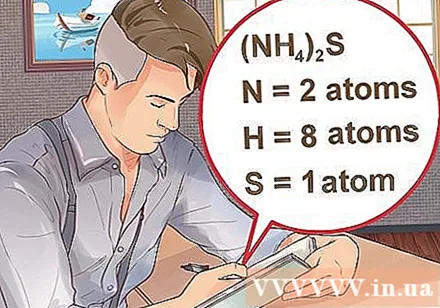
- Ef efnasamband er skrifað innan sviga, ásamt litlum vísitölu, þýðir það að hvert innihaldsefni innan sviga margfaldar vísitöluna. Dæmi: efnasamband (NH4)2S samanstendur af tveimur N atómum, átta H atómum og einu S atómi.

Skrifaðu niður rúmmáls atómpappír fyrir hvert frumefni. Notkun lotukerfisins er auðveldasta leiðin til að finna rúmmálsatóm frumefnis. Eftir að þú hefur fundið frumefnið í lotukerfinu sérðu atómmassann rétt fyrir neðan tákn frumefnisins.- Til dæmis er súrefnisatóm 15,99.
Reiknið sameindarmassa. Massasameind efnis er jöfn fjölda atóma hvers frumefnis margfaldað með massa atómi þess frumefnis. Þetta magn er nauðsynlegt í ummyndun gramma til mola.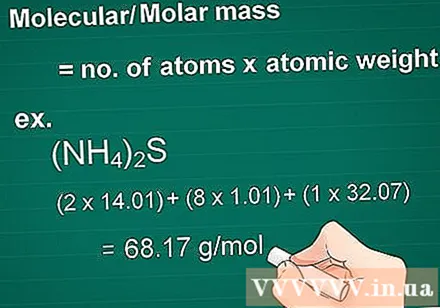
- Í fyrsta lagi margfaldaðu atómtölu hvers frumefnis í efnasambandinu með massa atómi þess.
- Bættu síðan massa frumefnanna í efnasambandinu saman við.
- Dæmi: Mólmassi efnasambands (NH4)2S = (2 x 14,01) + (8 x 1,01) + (1 x 32,07) = 68,17 g / mól.
- Sameindarmassi er einnig þekktur sem molamassi.
2. hluti af 2: Umreikna grömm í mól
Settu upp viðskiptaformúluna. Til að finna fjölda mól efnasambandsins skaltu deila grömmum efnasambandsins með mólmassa þess efnasambands.
- Formúla: fjöldi móla = massi (grömm) / mólmassi efnasambands (grömm / mól)
Skiptu tölunum út í formúluna. Eftir að rétt formúla hefur verið sett upp er næsta skref að skipta um tölurnar sem þú hefur reiknað út í formúluna. Ef þú vilt ganga úr skugga um að gögnin séu í réttri stöðu geturðu athugað þau með því að bæla eininguna niður. Ef eftir einfaldleikann er einingin sem eftir er mól þá ertu stillt rétt.
Leystu jöfnuna. Deildu massa með rúmsameind efnisins eða efnasambandsins með reiknivél. Stuðullinn er fjöldi mól efnisins eða efnasambandsins sem þú ert að leita að.
- Til dæmis er vandamálið að 2 g af vatni (H2O) og biðja þig um að breyta því í molareiningar. Við höfum molamassa H2O er 18g / mól. Deildu 2 með 18, þannig að þú hefur 0,1111 mol H2O.
Ráð
- Ekki gleyma að láta frumefni eða samsett heiti fylgja svörunum.
- Ef þú ert beðinn um að kynna æfingu eða spurningakeppni, vertu viss um að sýna svör þín skýrt með því að hringja eða teikna reit um svörin.
Það sem þú þarft
- Efnafræðilegt lotutafla
- Blýantur
- Pappír
- Tölva
- Efnafræðileg vandamál