Höfundur:
Lewis Jackson
Sköpunardag:
12 Maint. 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
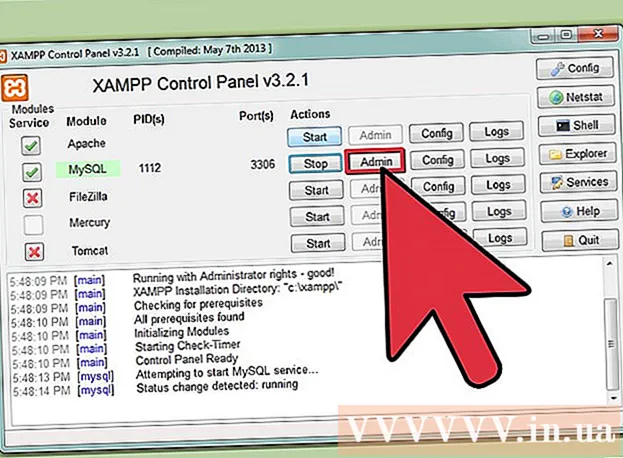
Að ákvarða fjölda nifteinda í atómi er frekar einfalt, þú þarft ekki einu sinni að gera neinar tilraunir. Til að reikna út fjölda nifteinda í venjulegu atómi eða samsætu þarftu bara að hafa lotukerfið tilbúið og fylgja leiðbeiningunum.
Skref
Aðferð 1 af 2: Finndu fjölda nifteinda í venjulegu atómi
Ákveðið stöðu frumefnisins á lotukerfinu. Til dæmis munum við finna frumefnið osmium (Os) í sjöttu röðinni að ofan.

Finndu atómtölu frumefnisins. Þetta er mest áberandi tala sem fer fyrir hvern þátt og er fyrir ofan frumtáknið (á spjaldinu sem við notum eru engar aðrar tölur). Atómtala er fjöldi róteinda í einu atómi þess frumefnis. Os er talan 76, sem þýðir að það eru 76 róteindir í osmium atómi.- Fjöldi róteinda breytist aldrei í frumefni; það er í meginatriðum skilgreiningareinkenni frumefnis.

Finndu atómþyngd frumefnisins. Þessi tala er venjulega að finna undir aðaltákninu. Athugið að lotukerfið í þessu dæmi hefur aðeins lotutölu og enga lotuþyngd. Ekki allar reglulegar töflur. Osmium hefur lotuþyngdina 190,23.
Kringdu atómþyngdina að næstu heiltölu til að fá atómmassa. Til dæmis væri 190,23 ávöl í 190, þannig að atómmassi osmíums er 190.- Atómþyngd er meðaltal samsæta sama efnisþáttar og þess vegna er það venjulega ekki heil tala.
Dragðu lotunúmerið frá atómmassanum. Þar sem meginhluti atómmassans er massi róteinda og nifteinda, dregurðu fjölda róteinda frá atómmassanum (þ.e.a.s. atómtölu) muntu telja fáðu fjölda nifteinda í atóminu. Talan eftir aukastaf táknar mjög lítinn massa rafeinda í atóminu. Í þessu dæmi höfum við: 190 (massa atóm) - 76 (fjöldi róteinda) = 114 (fjöldi nifteinda).
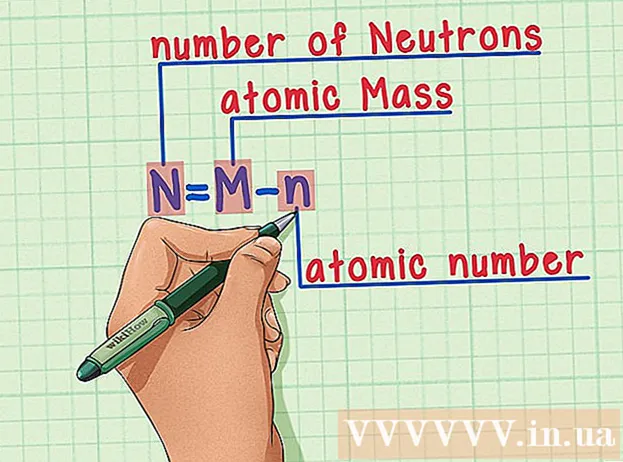
Leggið uppskriftina á minnið. Til að finna fjölda nifteinda beitum við einfaldlega eftirfarandi formúlu:
- N = M - n
- N = fjöldi nifteinda
- M = atómmassi
- n = lotutala
- N = M - n
Aðferð 2 af 2: Finndu fjölda nifteinda í samsætunni
Ákveðið stöðu frumefnisins á lotukerfinu. Tökum frumefnið kolefni-14 samsætuna sem dæmi. Þar sem samsætuform kolefnis-14 er einfaldlega kolefni (C), leitaðu að kolefni í reglulegu töflu (önnur röð efst).
Finndu atómtölu frumefnisins. Þetta er mest áberandi tala sem fer fyrir hvern þátt og er fyrir ofan frumtáknið (á spjaldinu sem við notum eru engar aðrar tölur). Atómtala er fjöldi róteinda í einu atómi þess frumefnis. C er númer 6, sem þýðir að það eru 6 róteindir í kolefnisatómi.
Finndu atómmassa. Þetta er afar auðvelt með samsætur vegna þess að þær eru nefndar eftir atómmassa. Til dæmis myndi kolefni-14 hafa atómmassa 14. Þegar þú hefur fundið atómmassa samsætunnar, þá eru skrefin sem eftir eru til að finna fjölda nifteinda þau sömu og venjulegs atóms.
Dragðu lotunúmerið frá atómmassanum. Þar sem meginhluti atómmassans er massi róteinda og nifteinda, dregurðu fjölda róteinda frá atómmassanum (þ.e.a.s. atómtölu) muntu telja fáðu fjölda nifteinda í atóminu. Talan eftir aukastaf táknar mjög lítinn massa rafeinda í atóminu. Í þessu dæmi höfum við: 14 (massa atóm) - 6 (fjöldi róteinda) = 8 (fjöldi nifteinda).
Leggið uppskriftina á minnið. Til að finna fjölda nifteinda beitum við eftirfarandi formúlu:
- N = M - n
- N = fjöldi nifteinda
- M = atómmassi
- n = lotutala
- N = M - n
Ráð
- Massi frumefnis er að mestu leyti fjöldi róteinda og nifteinda, en fjöldi rafeinda og annarra frumefna er hverfandi (næstum núll). Þar sem massi róteindarinnar er um það bil jafn nifteindinni og atómtölan táknar fjölda róteinda, þá þurfum við aðeins að draga fjölda róteinda frá heildarmassanum.
- Ef þú manst ekki merkingu tölanna í lotukerfinu skaltu muna að lotukerfið er venjulega byggt á atómtölum (þ.e. fjölda róteinda), byrjar á 1 (vetni) og hækkar eina einingu frá vinstri til hægri og endar með 118 (ununoctium). Þar sem fjöldi róteinda er auðkennandi eiginleiki hvers atóms er það einfaldasta eignin sem frumefnunum er raðað á. (Til dæmis er atóm með 2 róteindum alltaf helíum, rétt eins og atóm með 79 róteindum er alltaf gull.)
Heimildir og tilvitnanir
- Gagnvirk regluleg tafla