Höfundur:
Louise Ward
Sköpunardag:
11 Febrúar 2021
Uppfærsludagsetning:
1 Júlí 2024

Efni.
Stærð atóms er svo lítil að erfitt er að mæla nákvæmlega atómtölu efnasambands. Til að geta mælt magn efna nákvæmlega nota vísindamenn einingu mól til að tákna tiltekinn fjölda frumeinda. Eitt mól efnis er skilgreint sem jafngildir fjölda kolefnisatóma sem eru í 12 grömmum af 12 kolefnis samsætunni, sem er um það bil 6.022 x 10 atóm. Þetta gildi er kallað Avogadro númerið, eða Avogadro fasti. Þetta er einnig kallað fjöldi frumeinda í 1 mól hvers frumefnis og 1 mól af massa efnis er kallað mólmassi þess efnis.
Skref
Aðferð 1 af 2: Reiknið molamassa frumefnis
Skilgreining á molamassa. Mólmassi efnis er massi (í grömmum) eins móls af því efni. Til að reikna molamassa frumefnis, margföldu atómmassa þess með gramm-á-mól umbreytingarstuðli (g / mól).
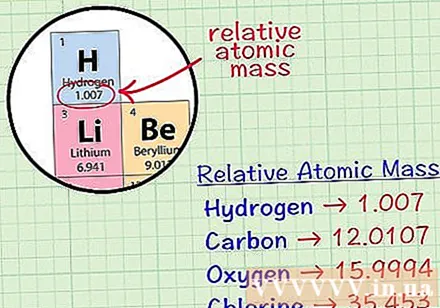
Finndu meðaltals rúmmatóm frumefnis. Meðalmassatóm frumefnis er meðalmassi, í lotueiningum, í sýni sem inniheldur allar samsætur þess frumefnis. Þessar upplýsingar eru oft gefnar í reglubundnu frumefni. Með því að finna frumefni geturðu fundið meðaltal rúmmálsatóm skrifað rétt fyrir neðan efnatákn frumefnisins. Þetta gildi er ekki heiltala, heldur tala með aukastöfum.- Til dæmis, með vetni er meðalmassatóm 1,007; Meðal rúmmetisatóm kolefnis er 12.0107; Meðalmassatóm súrefnis er 15.9994; klór hefur atómmassa að meðaltali 35.453.

Margfaldaðu meðaltalsmassatóm með mólmassa stöðugum. Einingin molar svif er skilgreind sem 0,001 kíló á mol, eða 1 grömm á mol. Afurð meðaltalsmassatómsins og mólmassastöðuginn umbreytir atómmassaeiningunni í grömm á mól, þannig að mólmassi vetnis verður 1.007 grömm á mól, kolefni er 12. , 0107 grömm á mól, súrefni er 15.9995 grömm á mól og klór er 35.453 grömm á mól.- Sum frumefni eru til í náttúrunni sem sameindir sem samanstanda af tveimur eða fleiri sömu atómum. Það er að segja ef þú vilt reikna mólmassa efnasambanda sem samanstanda af fleiri en einu atómi, svo sem vetnisgas, súrefnisgas eða klórgas, þarftu að ákvarða meðaltals atómmassa efnasambandsins og margfalda þetta gildi. með molamassanum stöðugum, '' þá '' margföldaðu vöruna sem þú varst að finna með 2.
- Með H2: 1.007 x 2 = 2.014 grömm á mol; fyrir O2: 15.9994 x 2 = 31.9988 grömm á mol; og Cl2: 35,453 x 2 = 70,096 grömm á mol.
Aðferð 2 af 2: Reiknið molamassa efnasambandsins

Ákveðið uppbyggingarformúlu efnasambandsins. Uppbyggingarformúla efnis gefur atómanúmer hvers frumefnis sem myndar það efnasamband. (Þessar upplýsingar eru til í öllum uppflettiritum). Til dæmis er efnaformúla saltsýru HCl; af glúkósa er C6H12O6. Með þessari byggingarformúlu getum við ákvarðað fjölda hverrar tegundar atóms sem mynda efnasambandið sem verið er að skoða.- Þar sem HCl hefur eitt vetnisatóm og eitt klóratóm.
- Glúkósusykursameind C6H12O6 hefur 6 kolefnisatóm, 12 vetnisatóm og 6 súrefnisatóm.
Ákveðið meðaltalsmassatóm hvers efnisþáttar. Notaðu lotukerfið til að finna meðalmassatóm hvers frumefnis sem er í efnasambandinu. Meðalmassatóm er venjulega skrifað undir efnatákn frumefnisins á reglulegu töflu. Líkur á að reikna mólmassa frumefnis, margföldaðu meðaltalsmassatómið með 1 grammi / móli.
- Meðalmassatóm frumefnanna sem mynda saltsýru er sem hér segir: vetni 1.007 g / mól og klór 35.453 g / mól.
- Meðalmassatóm frumefnanna sem mynda glúkósasameindina er: kolefni, 12.017 g / mól; vetni, 1.007 g / mól; og súrefni, 15.9995 g / mól.
Reiknið molamassa hvers frumefnis. Að margfalda massa atóm frumefnis með fjölda atóma sem það leggur til í efnasambandi gefur meðalmassa frumefnisins í efnasambandinu.
- Þegar um er að ræða saltsýru, saltsýru, er molamassi frumefnisins vetni 1.007 g / mól og klór er 35.453 g / mól.
- Þegar um glúkósa er að ræða, C6H12O6, mólmassi hvers frumefnis er sem hér segir: kolefni, 12.0107 x 6 = 72.0642 g / mól; vetni, 1.007 x 12 = 12.084 g / mól; súrefni, 15.9995 x 6 = 95.9964 g / mól.
Summa af mólmassa efnisþáttanna. Heildarmólmassi rotmassaþáttanna er molamassi efnasambandsins.Í fyrra þrepi reiknuðum við út molamassa hvers frumefnis sem er til staðar í efnasambandinu. Í þessu skrefi þurfum við bara að bæta öllum þessum gildum saman.
- Mólmassi saltsýru er 1.007 + 35.453 = 36.460 g / mól. 36,46 grömm er massi 1 mól af saltsýru.
- Mólmassi glúkósa er 72.0642 + 12.084 + 95.9964 = 180.1466 g / mól. Þannig að hvert mol af glúkósa hefur 180,14 grömm.
Ráð
- Þó að í flestum tilfellum sé meðalmassatóm skráð í næsta hluta 1000 (4 aukastafir), en á rannsóknarstofum er molamassinn oft minnkaður í 2 aukastafi, stundum jafnvel minna, fyrir stórar sameindir. Þess vegna, í rannsóknarstofu tilvikinu, má skrifa molamassa saltsýru sem 36,46 grömm á mól, fyrir glúkósa 180,14 grömm á mól.
Það sem þú þarft
- Efnafræðirit eða reglubundið frumefni
- Tölva