Höfundur:
Sara Rhodes
Sköpunardag:
12 Febrúar 2021
Uppfærsludagsetning:
1 Júlí 2024
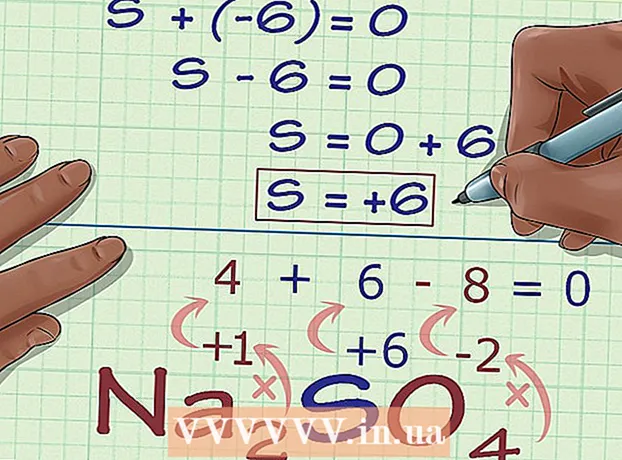
Efni.
- Skref
- Hluti 1 af 2: Ákvörðun oxunarástands samkvæmt efnafræðilegum lögum
- 2. hluti af 2: Ákvarða oxunarástand án þess að nota efnafræðilögmálin
- Ábendingar
- Hvað vantar þig
Í efnafræði merkja hugtökin „oxun“ og „lækkun“ viðbrögð þar sem atóm eða hópur atóma missa eða fá rafeindir í sömu röð. Oxunarástandið er tölulegt gildi sem er úthlutað einu eða fleiri atómum sem einkennir fjölda endurúthlutaðra rafeinda og sýnir hvernig þessar rafeindir dreifast milli atóma meðan á viðbrögðum stendur. Ákvörðun á þessu gildi getur verið bæði einföld og nokkuð flókin aðferð, allt eftir atómum og sameindum sem samanstanda af þeim. Þar að auki geta atóm sumra frumefna haft nokkur oxunarástand. Sem betur fer eru einfaldar ótvíræðar reglur til að ákvarða oxunarástandið, til þess að nota það sjálfstraust er nóg að þekkja grunnatriði efnafræði og algebru.
Skref
Hluti 1 af 2: Ákvörðun oxunarástands samkvæmt efnafræðilegum lögum
 1 Ákveðið hvort efnið sem um ræðir sé frumefni. Oxunarástand frumeinda utan efnasambands er núll. Þessi regla gildir bæði um efni sem eru mynduð úr aðskildum frjálsum atómum og þeim sem samanstanda af tveimur eða fjölómatískum sameindum eins frumefnis.
1 Ákveðið hvort efnið sem um ræðir sé frumefni. Oxunarástand frumeinda utan efnasambands er núll. Þessi regla gildir bæði um efni sem eru mynduð úr aðskildum frjálsum atómum og þeim sem samanstanda af tveimur eða fjölómatískum sameindum eins frumefnis. - Til dæmis, Al(s) og Cl2 hafa oxunarástand 0, þar sem báðir eru í efnafræðilega óbundnu frumefni.
- Athugið að allotropic form brennisteins S8, eða octacera, þrátt fyrir óhefðbundna uppbyggingu þess, einkennist einnig af núll oxunarástandi.
 2 Ákveðið hvort efnið sem um ræðir sé samsett úr jónum. Oxunarástand jóna er jafnt hleðslu þeirra. Þetta á bæði við um ókeypis jónir og þá sem eru hluti af efnasamböndum.
2 Ákveðið hvort efnið sem um ræðir sé samsett úr jónum. Oxunarástand jóna er jafnt hleðslu þeirra. Þetta á bæði við um ókeypis jónir og þá sem eru hluti af efnasamböndum. - Til dæmis er oxunarástand Cl jónsins -1.
- Oxunarástand Cl jónsins í efnasambandi NaCl er einnig -1. Þar sem Na -jónið, samkvæmt skilgreiningu, hefur hleðslu +1, þá komumst við að þeirri niðurstöðu að hleðsla Cl -jónsins sé -1 og þar með oxunarástand þess -1.
 3 Vinsamlegast athugið að málmjónir geta haft nokkur oxunarástand. Frumeindir margra málmefna geta jónast í mismunandi magni. Til dæmis er jónhleðsla málms eins og járns (Fe) +2 eða +3. Hleðsla málmjóna (og oxunarástand þeirra) er hægt að ákvarða með hleðslum jóna annarra frumefna sem þessi málmur er hluti af efnasambandi; í textanum er þessi hleðsla merkt með rómverskum tölum: til dæmis hefur járn (III) oxunarástand +3.
3 Vinsamlegast athugið að málmjónir geta haft nokkur oxunarástand. Frumeindir margra málmefna geta jónast í mismunandi magni. Til dæmis er jónhleðsla málms eins og járns (Fe) +2 eða +3. Hleðsla málmjóna (og oxunarástand þeirra) er hægt að ákvarða með hleðslum jóna annarra frumefna sem þessi málmur er hluti af efnasambandi; í textanum er þessi hleðsla merkt með rómverskum tölum: til dæmis hefur járn (III) oxunarástand +3. - Sem dæmi má íhuga efnasamband sem inniheldur áljón. Heildarhleðsla af AlCl efnasambandi3 er núll.Þar sem við vitum að Cl jónir hafa -1 hleðslu og efnasambandið inniheldur 3 slíkar jónir, fyrir almenna hlutleysi efnisins sem um ræðir þarf Aljónið að hafa hleðslu +3. Þannig, í þessu tilfelli, er oxunarástand áls +3.
 4 Oxunarástand súrefnis er -2 (með nokkrum undantekningum). Í næstum öllum tilfellum hafa súrefnisatóm oxunarástand -2. Það eru nokkrar undantekningar frá þessari reglu:
4 Oxunarástand súrefnis er -2 (með nokkrum undantekningum). Í næstum öllum tilfellum hafa súrefnisatóm oxunarástand -2. Það eru nokkrar undantekningar frá þessari reglu: - Ef súrefni er í frumefni (O2), oxunarástand þess er 0, eins og í tilfelli annarra frumefna.
- Ef súrefni er hluti af peroxíð, oxunarástand þess er -1. Peroxíð eru hópur efnasambanda sem innihalda einfalt súrefnis-súrefnis tengi (þ.e. peroxíð anjón O2). Til dæmis í samsetningu H2O2 (vetnisperoxíð) súrefni hefur hleðslu- og oxunarástand -1.
- Þegar það er sameinað flúor hefur súrefni oxunarástand +2, lestu regluna fyrir flúor hér að neðan.
 5 Vetni hefur oxunarástand +1, með nokkrum undantekningum. Eins og með súrefni, þá eru líka undantekningar. Að jafnaði er oxunarástand vetnis +1 (ef það er ekki í grunnstöðu H2). Hins vegar, í efnasamböndum sem kallast hydrides, er oxunarástand vetnis -1.
5 Vetni hefur oxunarástand +1, með nokkrum undantekningum. Eins og með súrefni, þá eru líka undantekningar. Að jafnaði er oxunarástand vetnis +1 (ef það er ekki í grunnstöðu H2). Hins vegar, í efnasamböndum sem kallast hydrides, er oxunarástand vetnis -1. - Til dæmis, í H2O Oxunarástand vetnis er +1 vegna þess að súrefnisatóm hefur hleðslu -2 og tvær +1 hleðslur eru nauðsynlegar fyrir heildarhlutleysi. Engu að síður, í samsetningu natríumhýdríðs, er oxunarástand vetnis þegar -1, þar sem Na -jónið hefur +1 hleðslu, og fyrir almenna rafhlutleysið ætti hleðsla vetnisatómsins (og þar með oxunarástand þess) að vera vera -1.
 6 Flúor alltaf hefur oxunarástand -1. Eins og áður hefur komið fram getur oxunarástand sumra frumefna (málmjónir, súrefnisatóm í peroxíðum og svo framvegis) verið mismunandi eftir mörgum þáttum. Oxunarástand flúors er hins vegar undantekningalaust -1. Þetta stafar af því að þessi frumefni hefur mesta rafeindavæðingu - með öðrum orðum, flúoratóm eru síst til í að skilja við eigin rafeindir og draga virkast til sín erlendar rafeindir. Þannig er gjald þeirra óbreytt.
6 Flúor alltaf hefur oxunarástand -1. Eins og áður hefur komið fram getur oxunarástand sumra frumefna (málmjónir, súrefnisatóm í peroxíðum og svo framvegis) verið mismunandi eftir mörgum þáttum. Oxunarástand flúors er hins vegar undantekningalaust -1. Þetta stafar af því að þessi frumefni hefur mesta rafeindavæðingu - með öðrum orðum, flúoratóm eru síst til í að skilja við eigin rafeindir og draga virkast til sín erlendar rafeindir. Þannig er gjald þeirra óbreytt.  7 Summa oxunarástanda í efnasambandi er jöfn hleðslu þess. Oxunarástand allra atóma sem mynda efnasamband ætti að vera allt að hleðslu þessa efnasambands. Til dæmis, ef efnasamband er hlutlaust, ætti summa oxunarástanda allra atóma þess að vera núll; ef efnasambandið er fjölliðjujón með hleðslu -1 er summa oxunarástandanna -1 osfrv.
7 Summa oxunarástanda í efnasambandi er jöfn hleðslu þess. Oxunarástand allra atóma sem mynda efnasamband ætti að vera allt að hleðslu þessa efnasambands. Til dæmis, ef efnasamband er hlutlaust, ætti summa oxunarástanda allra atóma þess að vera núll; ef efnasambandið er fjölliðjujón með hleðslu -1 er summa oxunarástandanna -1 osfrv. - Þetta er góð prófunaraðferð - ef summa oxunarríkjanna er ekki jöfn heildarhleðslu efnasambandsins, þá hefur þú rangt fyrir þér einhvers staðar.
2. hluti af 2: Ákvarða oxunarástand án þess að nota efnafræðilögmálin
 1 Finndu atóm sem hafa ekki strangar reglur um oxunarástand þeirra. Fyrir suma þætti eru engar fastar reglur til að finna oxunarástandið. Ef atóm passar ekki við neinar af reglunum sem taldar eru upp hér að ofan og þú veist ekki hleðslu þess (til dæmis er atómið hluti af fléttu og hleðsla þess er ekki tilgreind) getur þú ákvarðað oxunarástand slíks atóms með útilokun. Fyrst skaltu ákvarða hleðslu allra annarra atóma í efnasambandinu og reikna síðan oxunarástand þessa atóms út frá þekktri heildarhleðslu efnasambandsins.
1 Finndu atóm sem hafa ekki strangar reglur um oxunarástand þeirra. Fyrir suma þætti eru engar fastar reglur til að finna oxunarástandið. Ef atóm passar ekki við neinar af reglunum sem taldar eru upp hér að ofan og þú veist ekki hleðslu þess (til dæmis er atómið hluti af fléttu og hleðsla þess er ekki tilgreind) getur þú ákvarðað oxunarástand slíks atóms með útilokun. Fyrst skaltu ákvarða hleðslu allra annarra atóma í efnasambandinu og reikna síðan oxunarástand þessa atóms út frá þekktri heildarhleðslu efnasambandsins. - Til dæmis, í efnasambandinu Na2SVO4 hleðsla brennisteinsatómsins (S) er óþekkt - við vitum aðeins að það er ekki núll, þar sem brennisteinn er ekki í grunnstöðu. Þetta efnasamband þjónar sem gott dæmi til að sýna algebruíska aðferðina til að ákvarða oxunarástandið.
 2 Finndu oxunarástand þeirra efna sem eftir eru í efnasambandinu. Með því að nota reglurnar sem lýst er hér að ofan, ákvarða oxunarástand þeirra atóma sem eftir eru í efnasambandinu. Ekki gleyma undantekningunum frá reglunni fyrir O, H, og svo framvegis.
2 Finndu oxunarástand þeirra efna sem eftir eru í efnasambandinu. Með því að nota reglurnar sem lýst er hér að ofan, ákvarða oxunarástand þeirra atóma sem eftir eru í efnasambandinu. Ekki gleyma undantekningunum frá reglunni fyrir O, H, og svo framvegis. - Fyrir Na2SVO4með reglum okkar finnum við að hleðsla (og þar af leiðandi oxunarástand) Na -jónsins er +1 og fyrir hvert súrefnisatómið er það -2.
 3 Margfaldaðu fjölda atóma með oxunarástandi þeirra. Nú þegar við þekkjum oxunarástand allra atóma nema eins er nauðsynlegt að taka tillit til þess að það geta verið nokkur atóm sumra frumefna. Margfaldaðu fjölda atóma hvers frumefnis (það er gefið til kynna í efnaformúlu efnasambandsins sem undirskrift eftir tákni frumefnisins) með oxunarástandi þess.
3 Margfaldaðu fjölda atóma með oxunarástandi þeirra. Nú þegar við þekkjum oxunarástand allra atóma nema eins er nauðsynlegt að taka tillit til þess að það geta verið nokkur atóm sumra frumefna. Margfaldaðu fjölda atóma hvers frumefnis (það er gefið til kynna í efnaformúlu efnasambandsins sem undirskrift eftir tákni frumefnisins) með oxunarástandi þess. - Í Na2SVO4 við höfum 2 Na atóm og 4 atóm. Þannig að margfalda 2 × +1 fáum við oxunarástand allra Na atóma (2) og margfaldar 4 × -2 -oxunarástand O (-8) atómanna.
 4 Bættu saman fyrri niðurstöðum. Með því að draga saman niðurstöður margföldunar fáum við oxunarástand efnasambandsins án að teknu tilliti til framlags æskilegs atóms.
4 Bættu saman fyrri niðurstöðum. Með því að draga saman niðurstöður margföldunar fáum við oxunarástand efnasambandsins án að teknu tilliti til framlags æskilegs atóms. - Í dæmi okkar, fyrir Na2SVO4 við bætum við 2 og -8 og fáum -6.
 5 Finndu óþekkt oxunarástand frá hleðslu efnasambandsins. Þú hefur nú öll gögnin til að reikna auðveldlega út oxunarástandið. Skrifaðu niður jöfnu, vinstra megin við hana verður summan af tölunni sem fengin var í fyrra útreikningsþrepinu og óþekkt oxunarástandi, og hægra megin við heildarhleðslu efnasambandsins. Með öðrum orðum, (Summa þekktra oxunarástanda) + (æskilegt oxunarástand) = (hleðsla efnasambands).
5 Finndu óþekkt oxunarástand frá hleðslu efnasambandsins. Þú hefur nú öll gögnin til að reikna auðveldlega út oxunarástandið. Skrifaðu niður jöfnu, vinstra megin við hana verður summan af tölunni sem fengin var í fyrra útreikningsþrepinu og óþekkt oxunarástandi, og hægra megin við heildarhleðslu efnasambandsins. Með öðrum orðum, (Summa þekktra oxunarástanda) + (æskilegt oxunarástand) = (hleðsla efnasambands).- Í okkar tilviki, Na2SVO4 lausnin lítur svona út:
- (Summa þekktra oxunarástanda) + (æskilegt oxunarástand) = (samsett hleðsla)
- -6 + S = 0
- S = 0 + 6
- S = 6.V Na2SVO4 brennisteinn hefur oxunarástand 6.
- Í okkar tilviki, Na2SVO4 lausnin lítur svona út:
Ábendingar
- Í efnasamböndum verður summa allra oxunarástanda að jafna hleðsluna. Til dæmis, ef efnasambandið er kísilgúrtjón, þarf summa oxunarástanda atómanna að vera jöfn jónhleðslunni.
- Það er mjög gagnlegt að geta notað lotukerfið og vita hvar málmþættir og málmlausir þættir eru staðsettir í því.
- Oxunarástand frumeinda í frumformi er alltaf núll. Oxunarástand einrar jóns er jafnt hleðslu þess. Frumefni í hópi 1A lotukerfisins, svo sem vetni, litíum, natríum, í frumefni hafa oxunarástand +1; Oxunarástand hópa 2A málma, svo sem magnesíums og kalsíums, er +2 í frumefni. Súrefni og vetni, allt eftir gerð efnasambands, geta haft 2 mismunandi oxunarástand.
Hvað vantar þig
- Lotukerfi frumefna
- Internetaðgangur eða efnafræði tilvísunarbækur
- Blað, pappír eða blýantur
- Reiknivél



