Höfundur:
Randy Alexander
Sköpunardag:
25 April. 2021
Uppfærsludagsetning:
26 Júní 2024
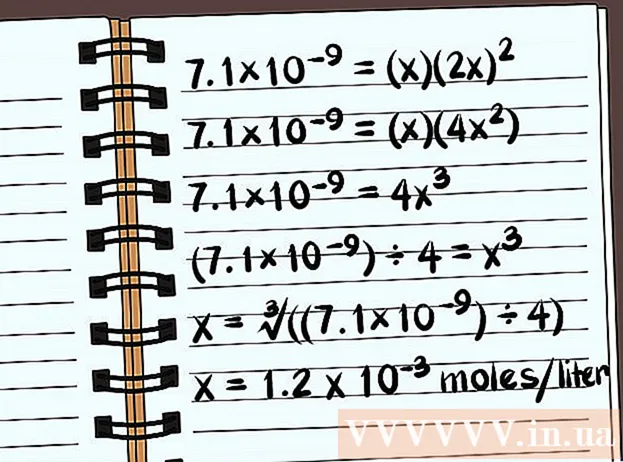
Efni.
Í efnafræði er leysni notuð til að lýsa eiginleikum fasts efnasambands þegar það er uppleyst að fullu í vökva án þess að skilja eftir óleysanlegar leifar. Aðeins jónísk efnasambönd (hlaðin) eru leysanleg. Reyndar þarftu aðeins að leggja nokkrar meginreglur á minnið eða fletta upp í bókmenntunum til að vita hvort jónískt efnasamband verður áfram fast þegar því er bætt í vatn eða ef mikið magn leysist upp. Reyndar leysist ákveðið magn af sameindum jafnvel þó að þú sjáir engar breytingar, svo til að tilraunin sé nákvæm þarftu að vita hvernig á að reikna þetta magn af uppleystu efni.
Skref
Aðferð 1 af 2: Notaðu fljótlegar reglur
Lærðu um jónasambönd. Hvert atóm hefur venjulega ákveðinn fjölda rafeinda, en stundum fær það eða gefur frá sér rafeind. Þetta ferli gerir það að einu jónir ákærður. Þegar jóna með neikvæða hleðslu (umfram einn rafeind) lendir í jón með jákvæðu hleðslu (vantar rafeind), munu þau tengjast saman eins og bakskautið og anóði tveggja segla. Niðurstaðan myndar jónískt efnasamband.
- Jónar hafa neikvæða hleðslu sem kallast anjónur, og jónir hafa jákvæða hleðslu sem kallast katjón.
- Venjulega er fjöldi rafeinda í atóm jafnt og fjöldi róteinda, svo það hefur enga hleðslu.

Skilja leysni. Vatnssameind (H2O) hefur óreglulega uppbyggingu svo hún líkist segul: annar endinn hefur jákvæða hleðslu og hinn hefur neikvæða hleðslu. Þegar þú setur jónískt efnasamband í vatn safnast þessi "segull" vatns í kringum það og reynir að draga jákvæðu og neikvæðu jónirnar í sundur.- Sum jónísk efnasambönd frásogast ekki mjög vel, þau eru talin leysanlegt Vegna þess að það mun aðskiljast og leysast upp þegar því er bætt við vatn. Önnur efnasambönd hafa sterkari tengi óleysanlegt vegna þess að jónar laðast hver að öðrum óháð aðdráttarafl vatnssameindarinnar.
- Sum efnasambönd hafa bindiskraft sem jafngildir aðdráttarafl vatnssameindar. Þau eru talin örlítið leysanlegt vegna þess að flest efnasambönd verða aðskilin, en restin mun samt laðast að hvort öðru.

Skilja meginregluna um upplausn. Þar sem samspil frumeinda er svo flókið geturðu ekki treyst alfarið á innsæi til að greina hvaða efnasambönd geta eða geta ekki. Flettu upp fyrstu jónina í efnasambandinu á listanum hér að neðan með tilliti til sameiginlegra eiginleika hennar og athugaðu hvort undantekningar séu til að tryggja að önnur jónin hafi ekki óeðlileg samskipti við hana.- Til dæmis til að athuga strontíumklóríð (SrCl2), vinsamlegast leitaðu að Sr eða Cl í feitletruðu skrefunum hér að neðan. Cl er „venjulega leysanlegt“ svo leitaðu að undantekningum fyrir neðan það. Sr er ekki á undantekningalistanum svo SrCl2 verður að vera leysanlegt.
- Algengustu undantekningarnar frá hverri reglu eru skrifaðar fyrir neðan regluna. Það eru aðrar undantekningar, en ólíklegt er að þær komi fram á venjulegum efnafræði eða vinnustundum.

Efnasambönd eru leysanleg þegar þau innihalda basa málma eins og Li, Na, K, Rb og Cs. Þessir málmar eru einnig þekktir sem hópur IA frumefna: litíum, natríum, kalíum, rúbídíum og cesíum. Næstum öll efnasambönd sem innihalda eina af þessum jónum eru leysanleg.- Undantekning: Li3PO4 óleysanlegt.
ENGIN efnasambönd3, C2H3O2, NEI2, ClO3 og ClO4 eru öll leysanleg. Nöfnin sem svara til ofangreindra jóna eru nítrat, asetat, nítrít, klórat og perklórat. Athugið að asetat er oft skammstafað sem OAc.
- Undantekning: Ag (OAc) (silfurasetat) og Hg (OAc)2 (kvikasilfur asetat) óleysanlegt.
- AgNO2 og KClO4 aðeins „aðeins bráðnað“.
Efnasamböndin Cl, Br og I eru venjulega leysanleg. Klóríð-, brómíð- og joðíðjónir mynda næstum alltaf leysanleg efnasambönd, kölluð halógen sölt.
- Undantekning: Ef einhver af ofangreindum jónum sameinast silfurjónum Ag, kvikasilfur Hg2, eða Pb blý, mynda óleysanleg efnasambönd. Sama gildir um sjaldgæfari efnasambönd sem myndast þegar þau eru sameinuð með kopar Cu og thali Tl.
Efnasambönd sem innihalda SO4 venjulega leysanlegt. Súlfatjónir mynda oft leysanleg efnasambönd en undantekningar eru margar.
- Undantekning: Súlfat jónir mynda óleysanlegt efnasamband með eftirfarandi jónum: strontium Sr, barium Ba, blý Pb, silfur Ag, kalsíum Ca, radium Ra og silfur monatom Ag2. Athugið að silfursúlfat og kalsíumsúlfat eru aðeins í meðallagi leysanlegt, svo sumir telja það vera örlítið leysanlegt.
Efni sem innihalda OH eða S eru óleysanleg. Samsvarandi heiti þessara jóna eru hýdroxíð og súlfíð.
- Undantekning: Manstu eftir alkalímálmum (hópur I-A) og hvernig þeir vilja mynda leysanleg efnasambönd? Li, Na, K, Rb og Cs mynda öll efnasambönd sem eru leysanleg með hýdroxíði eða súlfíðjónum. Að auki mynda hýdroxíð sölt sem eru leysanleg með jarðalkalíumjónum (hópur II-A): kalsíum Ca, strontium Sr og barium Ba. Athugið: efnasambönd úr hýdroxíðum og jarðalkalímálmum hafa í raun verulegan fjölda sameinda sem haldast bundin saman, svo þau eru stundum talin „örlítið leysanleg“.
Efnasambönd sem innihalda CO3 eða PO4 óleysanlegt. Athugaðu í síðasta skipti fyrir karbónat- og fosfatjónir og þú munt sjá hvort efnasamband þitt er leysanlegt.
- Undantekning: Þessar jónir mynda efnasambönd sem eru leysanleg með basa málmum eins og Li, Na, K, Rb og Cs, svo og með ammóníum jón NH4.
Aðferð 2 af 2: Reiknið leysni út frá stöðugum Ksp
Leitaðu að leysanleika stöðugum Ksp. Þessi fasti er mismunandi fyrir hvert efnasamband, svo þú ættir að fletta því upp á línuriti í kennslubók eða á netinu. Þar sem þessi gildi eru ákvörðuð með tilraunum og geta verið breytileg milli grafa er best að nota línurit kennslubókarinnar ef það er til. Nema annað sé tekið fram gera flestar lóðir ráð fyrir 25 ° C prófunarhita.
- Við skulum til dæmis segja að þú sért að leysa upp blý joðíð með formúlunni PbI2, skrifaðu leysanleika vöru sína stöðuga. Ef þú vísar í línuritið á bilbo.chm.uri.edu notarðu stöðuga 7,1 × 10.
Skrifaðu efnajöfnu. Sá fyrsti ákvarðar jónaðskilnaðarmynstur þessa efnasambands þegar það er uppleyst. Skrifaðu síðan jöfnuna með Ksp á annarri hliðinni og hluti jónir á hinni hliðinni.
- Til dæmis PbI sameind2 sundrast í jónum Pb, I og I. (Þú þarft aðeins að vita eða athuga hleðslu jóna, þar sem öll efnasambönd eru alltaf rafhlutlaus).
- Skrifaðu jöfnu 7,1 × 10 =
- Þessi jöfna er leysanleikafastan, þú getur fundið út fyrir 2 jónir í leysileikitöflu. Þar sem það eru 2 l-jón verður l- að vera fjórfalt.
Umbreyttu jöfnum til að nota breytur. Endurskrifaðu jöfnuna með venjulegum algebrufræðilegum aðferðum og notaðu upplýsingarnar sem þú þekkir um fjölda sameinda og jóna. Stilltu x jafnt og massa efnasambandsins sem á að leysast upp og skrifaðu um jöfnu þar sem x táknar fjölda hverrar jónu.
- Í þessu dæmi þurfum við að endurskrifa jöfnuna 7,1 × 10 =
- Þar sem aðeins er ein blýjón (Pb) í efnasambandinu er fjöldi sameinda sem eru uppleyst jafn fjöldi frjálsra blýjóna. Þess vegna getum við stillt það á x.
- Þar sem það eru tvö joðjónir (I) fyrir hverja blýjón, stillum við fjölda joðatóna jafnt og 2x.
- Nú verður jöfnunin 7,1 × 10 = (x) (2x)
Taktu tillit til algengra jóna, ef einhverjar eru. Slepptu þessu skrefi ef þú ert að leysa efnasambandið upp í eimuðu vatni. Ef efnasamband er leyst upp í lausn sem hefur nú þegar einn eða fleiri hluti jóna („algengar jónir“) mun leysni efnasambandsins minnka verulega. Áhrif almennu jóna verða augljósust á nánast óleysanleg efnasambönd og í þessu tilfelli má gera ráð fyrir að flestir jónir við jafnvægi séu þeir sem áður voru í lausn. Endurskrifaðu jöfnuna til að reikna mólstyrk (mól á lítra eða M) jóna sem þegar eru í lausninni, og skiptu þessu gildi út fyrir breytuna x sem þú notar fyrir þá jón.
- Til dæmis ef blý joðíð efnasambandið er leyst upp í 0,2M blý klóríð (PbCl) lausn2) munum við endurskrifa jöfnuna sem 7,1 × 10 = (0,2M + x) (2x). Þar sem 0,2M er hærri styrkur en x gætum við endurskrifað hann í 7,1 × 10 = (0,2M) (2x).
Leystu jöfnuna. Leysið í x og þá sérðu leysni efnasambandsins. Í skilgreiningunni á leysanleika stöðugleika verður þú að skrifa svarið með tilliti til fjölda móls efnasambandsins uppleyst á lítra af vatni. Þú gætir þurft að nota tölvuna þína til að finna endanlegt svar.
- Eftirfarandi dæmi er leysni í eimuðu vatni án algengra jóna.
- 7.1 × 10 = (x) (2x)
- 7.1 × 10 = (x) (4x)
- 7,1 × 10 = 4x
- (7,1 × 10) ÷ 4 = x
- x = ∛ ((7,1 × 10) ÷ 4)
- x = 1,2 x 10 mól á lítra leysast upp. Þetta er mjög lítill massi, svo þetta efnasamband er næstum óleysanlegt.
Það sem þú þarft
- Tafla yfir fastanleika framleiðsluafurða efnasambandsins (Ksp)
Ráð
- Ef þú hefur tilraunagögn um magn efnasambanda sem eru uppleyst, getur þú notað sömu jöfnu til að leysa leysanleika stöðugleika K.sp.
Viðvörun
- Ekki er samstaða um skilgreiningar þessara hugtaka en efnafræðingar eru sammála um meirihluta efnasambanda. Fjöldi sérstakra efnasambanda þar sem bæði leysanlegar og óleysanlegar sameindir eru mikilvægir efnisþættir, hver með mismunandi lýsingu á þessum efnasamböndum.
- Sumar gamlar kennslubækur sjá NH4OH er leysanlegt efnasamband. Þetta er ekki satt; Lítið magn af NH jónum fannst4 og OH en þessar tvær jónir geta ekki sameinast í efnasambönd.