Höfundur:
Lewis Jackson
Sköpunardag:
12 Maint. 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
Rafstillingar atóms er röð talna sem tákna rafeindarbrautir. Rafeindóbítanar eru landshlutar af mismunandi stærðum sem umlykja kjarna atóms þar sem rafeindum er raðað skipulega. Með rafeindastillingu geturðu fljótt ákvarðað hversu mörg rafeindabrautir eru í atóminu og fjöldi rafeinda í hverri braut. Þegar þú hefur skilið grundvallarreglur rafeindastillinga, munt þú geta skrifað eigin rafeindastilling og getað gert efnafræðilegar prófanir af öryggi.
Skref
Aðferð 1 af 2: Finndu fjölda rafeinda með því að nota reglulega efnafræðilega töflu
Finndu atóm númer atómsins. Hvert atóm hefur ákveðinn fjölda rafeinda sem tengjast því. Finndu þáttinn í reglulegu töflu. Atómtölan er jákvæð heiltala sem byrjar á 1 (fyrir vetni) og hækkar um 1 fyrir hvert atóm eftir það. Atómtala er fjöldi róteinda atómsins - svo það er líka fjöldi rafeinda atómsins í jörðu ástandi.
- Ákveðið hleðslu atómsins. Rafhlutlaust atóm hefur réttan fjölda rafeinda eins og sýnt er á reglulegu töflu. Atóm með hleðslu mun þó hafa meira eða minna rafeindir miðað við hleðslustærð þess. Ef þú ert að vinna með frumeindir með hleðslu skaltu bæta við eða draga frá samsvarandi fjölda rafeinda: bæta við einni rafeind fyrir hverja neikvæða hleðslu og draga einn rafeind fyrir hverja jákvæða hleðslu.
- Sem dæmi má nefna að natríumatóm með hleðslu +1 mun hafa einn rafeind fjarlægðan grunnatóm númer 11. Þess vegna mun natríum atómið hafa alls 10 rafeindir.
- Leggðu grunnbrautarlistann á minnið. Þegar frumeind tekur á móti rafeindum verður þessum rafeindum raðað í svigrúm í ákveðinni röð. Þegar rafeindirnar fylla svigrúm er fjöldi rafeinda í hverri svigrúm jafn. Við höfum eftirfarandi svigrúm:
- Obitan s (hvaða tala sem er með „s“ að aftan í rafeindastillingunni) hefur aðeins einn svigrúm og fylgir Meginreglan nema PauliHver svigrúm inniheldur að hámarki 2 rafeindir, þannig að hver svigrúm inniheldur aðeins 2 rafeindir.
- Obitan bls hefur 3 svigrúm, þannig að það getur geymt allt að 6 rafeindir.
- Obitan d hefur 5 svigrúm, þannig að það getur geymt allt að 10 rafeindir.
- Obitan f hefur 7 svigrúm, þannig að það getur geymt allt að 14 rafeindir. Leggið röð raðbrautanna á minnið samkvæmt eftirfarandi grípandi setningu:
Sá Párásargjarn Duh Fallt í lagi Gdofinn HÚbbs ÍKÉg kem.
Fyrir frumeindir með fleiri rafeindum, eru svigrúm áfram skrifuð í stafrófsröð eftir bókstafnum k og sleppa persónunum sem voru notaðar.
- Skilja stillingar rafeinda. Rafstillingar eru skrifaðar til að sýna skýrt fjölda rafeinda í atóminu, svo og fjölda rafeinda í hverri braut. Hvert svigrúm er skrifað í ákveðinni röð, með fjölda rafeinda í hverju svigrúmi skrifað fyrir ofan réttinn á svigrúminu. Að lokum er rafeindastillingin röð sem samanstendur af nöfnum svigrúmanna og fjölda rafeinda sem eru skrifaðar hér að ofan til hægri við þær.
- Eftirfarandi dæmi er einföld rafeindastilling: 1s 2s 2p. Þessi stilling sýnir að það eru tvær rafeindir í 1s svigrúminu, tvær rafeindir í 2s svigrúminu og sex rafeindir í 2p svigrúminu. 2 + 2 + 6 = 10 rafeindir (samtals). Þessi rafeindastilling er fyrir rafhlutlaust neonatóm (atómtala neons er 10).
- Leggðu minningarröð um sporbrautir. Athugið að svigrúm er númerað eftir rafeindaflokki en er orkumikið raðað. Til dæmis er 4s mettaður með minni orku (eða endingarbetri) en mettaði eða ómettaði 3d hringbrautin, svo 4s undirflokkurinn er skrifaður fyrst. Þegar þú veist röð svigrúmanna geturðu raðað rafeindunum í þær í samræmi við fjölda rafeinda í atóminu. Röðin til að setja rafeindir í svigrúm er eftirfarandi: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s.
- Rafeindastilling atóms með hverju rafeindafylltu svigrúmi er skrifuð svona: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d7p
- Athugaðu að ef öll lögin eru fyllt er ofangreind rafeindastilling sú sem er í Og (Oganesson), 118, sem er hæsta númeraða atómið í lotukerfinu - sem inniheldur öll þekkt rafeindalög fyrir með rafhlutlaust atóm.
- Flokkaðu rafeindir í svigrúm eftir fjölda rafeinda í atóminu. Til dæmis, ef þú vilt skrifa rafeindarstillingu rafhlutlausa kalsíumatómsins, þá er það fyrsta sem þú þarft að gera að finna lotunúmer þess á lotukerfinu. Atómtala kalsíums er 20, þannig að við munum skrifa stillingu atóms með 20 rafeindum í röðinni hér að ofan.
- Settu rafeindir þínar í svigrúm í röðinni hér að ofan þar til þú hefur náð 20 rafeindum. Obitan 1s fær tvær rafeindir, 2s fær tvær, 2p fær sex, 3s fær tvær, 3p fær sex og 4s fær tvær (2 + 2 + 6 +2 +6 + 2 = 20). Þess vegna er rafeindastilling kalsíums: 1s 2s 2p 3s 3p 4s.
- Athugið: Orkustigið breytist þegar rafeindalagið eykst. Til dæmis, þegar þú skrifar á 4. orkustig er 4s undirflokkurinn skrifaður fyrst, síðar til 3d. Eftir að þú hefur skrifað fjórða orkustigið, munt þú fara á fimmta stigið og hefja lagskiptingu aftur. Þetta gerist aðeins eftir 3. orkustig.
- Notaðu reglulegu töflu sem sjónflýtileið. Þú hefur ef til vill tekið eftir því að lögun lotukerfisins samsvarar röð svigrúm í rafeindastillingum. Til dæmis endar atóm í annarri vinstri dálki alltaf á „s“, atóm lengst til hægri á miðhlutanum endar alltaf á „d“ o.s.frv. Notaðu reglulegu töflu til að skrifa mannvirki. mynd - röðin sem rafeindirnar eru settar í svigrúm samsvarar stöðunum sem sýndar eru á reglulegu töflu. Sjá fyrir neðan:
- Tveir vinstri súlurnar eru frumeindir þar sem rafeindastilling endar á svigrúminu, hægri hluti lotukerfisins er frumeindir með rafeindastilling sem endar á svigrúminu, miðhlutinn er atóm sem endar á svigrúminu. d, og fyrir neðan eru atómin sem enda á f svigrúminu.
- Til dæmis, þegar þú ritar rafeindastillingar fyrir frumefnið klór, færðu eftirfarandi rök: Þetta atóm er í þriðju röðinni (eða „tímabilinu“) í lotukerfinu. Það er einnig í fimmta dálki p svigrúmsblokkarinnar á reglulegu töflu. Svo rafeindastillingin mun enda ... 3p.
- Varlega! D og f svigrúm flokka í lotukerfinu samsvarar öðruvísi orkustigum en tímabil þeirra. Til dæmis samsvarar fyrsta röðin af d svigrúminu 3d svigrúm þó að það sé á tímabili 4, en fyrsta röðin af f svigrúm samsvarar 4f svigrúminu þó að það sé á tímabili 6.
- Lærðu hvernig á að skrifa fallnar rafeindastillingar. Frumeindirnar meðfram hægri brún lotukerfisins eru kallaðar sjaldgæft gas. Þessir þættir eru efnafræðilega mjög óvirkir. Til að stytta leiðina til að skrifa langar rafeindastillingar skaltu skrifa í hornklofa efnatáknið fyrir næsta sjaldgæfa lofttegund sem hefur minni rafeindir en atómsins og halda síðan áfram að skrifa rafeindastillingar næstu svigrúm. . Sjá fyrir neðan:
- Til að skilja þetta hugtak, skrifaðu dæmi sem er hrunin rafeindastilling. Segjum sem svo að við þurfum að skrifa rafeindastillinguna til að draga úr sinki (lotu númer 30) í gegnum sjaldgæfar gasstillingar. Rafeindarstillingar sinksins eru: 1s 2s 2p 3s 3p 4s 3d. Athugaðu þó að 1s 2s 2p 3s 3p er stillingin fyrir sjaldgæft agonic gas. Skiptu bara um þennan hluta rafeindartáknunar sinksins með agonic efnafræðilegu tákninu innan sviga ().
- Þess vegna er rafeindastilling sink mjög þétt 4s 3d.
Aðferð 2 af 2: Notaðu lotukerfið ADOMAH

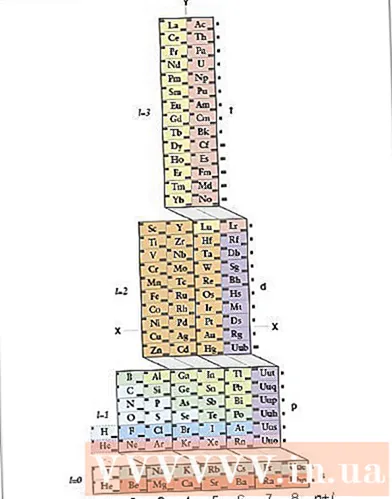
Skoðaðu ADOMAH reglulegu töfluna. Þessi aðferð við að skrifa rafeindastilling þarf ekki að leggja á minnið. Hins vegar krefst þessarar aðferðar endurskipulagt lotukerfi, því í venjulegu lotukerfi, frá fjórðu röðinni, samsvarar fjöldi lota ekki rafeindalaginu. Finndu ADOMAH Periodic Table, sérstakt efna-periodic borð sem er hannað af vísindamanninum Valery Tsimmerman. Þú getur fundið þessa reglulegu töflu á internetinu.- Í lotukerfinu ADOMAH eru láréttu raðir hópar frumefna eins og halógen, óvirkir lofttegundir, basa málmar, jarðalkalíumálmar osfrv. Lóðréttu súlurnar samsvara rafeindalaginu og eru kallaðar "stig" reitir s, p, d og f) samsvara tímabilinu.
- Helíum er raðað við hliðina á vetni því báðir eru með einstaka 1s hringbraut. Reglulegar blokkir (s, p, d og f) eru sýndar á hægri hlið og fjöldi rafeindalaga er sýndur við grunninn. Stafanöfn eru skrifuð í rétthyrningi sem er númeruð 1 til 120. Þessar tölur eru venjuleg atómtölur sem tákna heildarfjölda rafeinda í rafhlutlausu atómi.
- Finndu þætti í periodic ADOMAH. Til að skrifa rafeindasamsetningu frumefnis, finndu tákn þess á ADOMAH lotukerfinu og strikaðu yfir öll frumefni með hærri atómtölur. Til dæmis, ef þú vilt skrifa rafeindastillingu eribi (68), strikaðu yfir þætti 69 til 120.
- Athugið tölurnar 1 til 8 neðst í lotuborðinu. Þetta er fjöldi rafeindalaga eða dálka. Ekki taka eftir dálkum sem hafa aðeins strikað yfir þætti.Fyrir eribi eru eftirstandandi dálkar 1, 2, 3, 4, 5 og 6.
- Teljið fjölda svigrúm til stöðu atómsins til að skrifa stillinguna. Horfðu á reitstáknið sem sýnt er hægra megin við lotuborð (s, p, d og f) og skoðaðu fjölda dálka sem eru sýndir neðst í töflunni, óháð skáum línum milli kubba, skiptu súlum í dálkblokka og skrifaðu þeir eru í röð frá botni til topps. Hunsa dálkablokka sem innihalda aðeins strik yfir. Skrifaðu dálkablokka sem byrja á dálknúmerinu og síðan táknið fyrir reit, svona: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (ef um eribi er að ræða).
- Athugasemd: Ofangreind rafeindastilling fyrir Er er skrifuð í hækkandi röð af fjölda rafeindalaga. Þessa stillingu er einnig hægt að skrifa í þeirri röð að setja rafeindir í svigrúm. Fylgdu skrefunum frá toppi til botns í stað dálka þegar þú skrifar dálkblokka: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f.
- Teljið fjölda rafeinda á hringbraut. Teljið fjölda rafeinda sem ekki eru strikaðir yfir í hverri dálkblokk, úthlutið einni rafeind á hvert frumefni og skrifið fjölda rafeinda við hlið táknmyndar fyrir hvern súludálk, svona: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s. Í þessu dæmi er þetta rafeindastilling eribi.
- Kannast við óeðlilegar rafeindastillingar. Átján algengar undantekningar eru frá rafeindastillingum atóma í lægsta orkuástandi, einnig þekkt sem jörðuástand. Í samanburði við almenna þumalputtareglu víkja þeir aðeins frá síðustu tveimur til þremur rafeindastöðum. Í þessu tilfelli veldur raunveruleg rafeindastilling því að rafeindirnar hafa lægra orkuástand en venjulegar stillingar atómsins. Óvenjuleg atóm eru:
- Cr (..., 3d5, 4s1); Cu (..., 3d10, 4s1); Nb (..., 4d4, 5s1); Mán (..., 4d5, 5s1); Ru (..., 4d7, 5s1); Rh (..., 4d8, 5s1); Pd (..., 4d10, 5s0); Ag (..., 4d10, 5s1); La (..., 5d1, 6s2); Ce (..., 4f1, 5d1, 6s2); Guð (..., 4f7, 5d1, 6s2); Au (..., 5d10, 6s1); Ac (..., 6d1, 7s2); Þ (..., 6d2, 7s2); Pa (..., 5f2, 6d1, 7s2); U (..., 5f3, 6d1, 7s2); Np (..., 5f4, 6d1, 7s2) og Sentimetri (..., 5f7, 6d1, 7s2).
Ráð
- Þegar atómið er jón þýðir það að fjöldi róteinda er ekki jafn fjöldi rafeinda. Hleðsla atómsins er síðan sýnd í (venjulega) efra hægra horni tákn frumefnisins. Þess vegna hefur antimon atóm með hleðslu +2 rafeindastilling 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p. Athugið að 5p er breytt í 5p. Verið varkár þegar stilling rafs hlutlaust atóms endar á einhverjum sporbrautum en s og p. Þegar rafeindir eru fjarlægðar er aðeins hægt að taka rafeindir frá gildisbrautum (s og p svigrúm). Svo ef stilling endar á 4s 3d og atómið hefur hleðslu +2 breytist stillingin í 4s 3d. Við sjáum 3dstöðugur, en aðeins rafeindir í svigrúm eru fjarlægðar.
- Öll atóm hafa tilhneigingu til að snúa aftur í stöðugt ástand og stöðugasta rafeindastillingin hefur nóg s og p svigrúm (s2 og p6). Þessar sjaldgæfu lofttegundir eru með þessa rafeindastillingu og þess vegna taka þær sjaldan þátt í viðbrögðum og eru hægra megin við lotukerfið. Svo ef stilling endar í 3p, þá þarf aðeins að bæta við tveimur rafeindum til að verða stöðug (það að gefa frá sér sex rafeindir, þar á meðal hringbrautina, myndi krefjast meiri orku, svo það að gefa fjórar rafeindir væri auðvelt. auðveldara). Ef stilling endar í 4d þarf aðeins að gefa þrjár rafeindir til að ná stöðugu ástandi. Sömuleiðis eru nýju undirflokkarnir sem taka á móti helmingi rafeindanna (s1, p3, d5 ..) stöðugri, td p4 eða p2, en s2 og p6 verða enn stöðugri.
- Þú getur líka notað gildisrafstillinguna til að skrifa rafeindastillingu frumefnis, sem eru síðustu s og p svigrúm. Þess vegna er gildisuppsetning móteins atóms fyrir mótefni 5s 5p.
- Jónum líkar það ekki vegna þess að þær eru miklu endingarbetri. Slepptu ofangreindum tveimur skrefum þessarar greinar og vinnðu á sama hátt, allt eftir því hvar þú byrjar og hversu margar eða færri rafeindir þú hefur.
- Til að finna lotutöluna úr rafeindastillingunni skaltu bæta við öllum tölunum sem fylgja stafunum (s, p, d og f). Þetta er aðeins rétt ef það er hlutlaust atóm, ef það er jón þá geturðu ekki notað þessa aðferð. Í staðinn verður þú að bæta við eða draga frá fjölda rafeinda sem þú tekur inn eða gefur.
- Númerið sem fylgir stafnum verður að vera skrifað efst í hægra horninu, þú mátt ekki skrifa vitlaust þegar þú tekur prófið.
- Það eru tvær mismunandi leiðir til að skrifa rafeindastillingar. Þú getur skrifað í hækkandi röð rafeindalagsins eða í þeirri röð sem rafeindirnar eru settar í svigrúm, eins og sýnt er fyrir eribi atómið.
- Það eru dæmi um að „rafeinda þurfi upp“. Það er þegar svigrúm vantar aðeins eina rafeind til að hafa helminginn eða allar rafeindirnar, þá verður þú að taka rafeind frá næsta s eða p svigrúmi til að flytja hana í svigrúm sem þarfnast þess rafeinda.
- Við getum ekki sagt að „orkubrotastöðugleiki“ undirflokksins taki á móti helmingi rafeindanna. Það er of einföldun. Ástæðan fyrir stöðugu orkustigi nýja undirflokksins sem fær „helming fjölda rafeinda“ er sú að hver svigrúm hefur aðeins eina staka rafeind og því er rafeindavirkni fráleit.