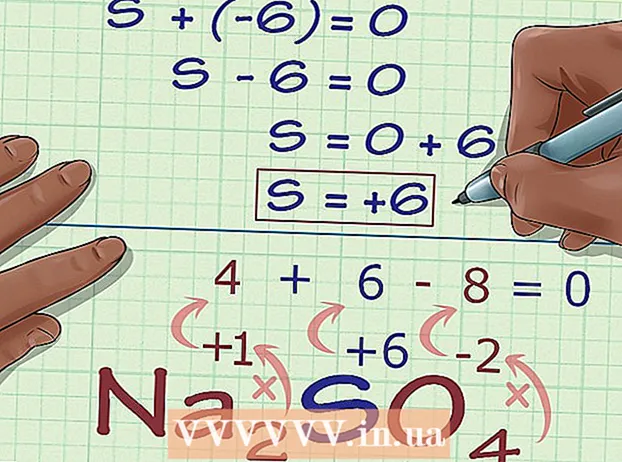
Efni.
- Að stíga
- Hluti 1 af 2: Úthluta oxunartölum byggðar á efnareglum
- 2. hluti af 2: Úthluta atómum tölum án reglna um oxunartölur
- Ábendingar
- Nauðsynjar
Í efnafræði þýðir hugtökin „oxun“ og „minnkun“ þau viðbrögð þar sem frumeind (eða hópur frumeinda) missir eða öðlast rafeindir, í sömu röð. Oxunartölur eru tölur sem gefnar eru frumeindum (eða hópum frumeinda) til að aðstoða efnafræðinga við að stjórna því hve margar rafeindir eru tiltækar til að flýja og hvort gefin hvarfefni oxast eða minnkar við hvarf. Ferlið við að úthluta atómum oxunartölum getur verið frá mjög einföldum til flóknara, allt eftir hleðslu frumeindanna og efnasamsetningu sameindanna sem þau eru hluti af. Til að gera hlutina flóknari geta sum frumeindir haft margar oxunartölur. Sem betur fer er úthlutun oxunartala stjórnað af skýrt skilgreindum reglum sem auðvelt er að fylgja, en grunnskilningur á efnafræði og algebru mun auðvelda notkun þessara reglna.
Að stíga
Hluti 1 af 2: Úthluta oxunartölum byggðar á efnareglum
 Ákveðið hvort efnið sem um ræðir sé frumefni. Frjáls, óbundin frumeindir hafa alltaf oxunartölu 0. Þetta gildir bæði um frumeindir sem samanstanda af einu atómi og frumeindum sem eru í frumefnaformi kísilgúr eða fjölatóm.
Ákveðið hvort efnið sem um ræðir sé frumefni. Frjáls, óbundin frumeindir hafa alltaf oxunartölu 0. Þetta gildir bæði um frumeindir sem samanstanda af einu atómi og frumeindum sem eru í frumefnaformi kísilgúr eða fjölatóm. - Til dæmis, Al(s) og Cl2 báðir hafa oxunartöluna 0 vegna þess að þau eru ekki samsett atóm.
- Athugið að brennisteinn í frumformi, S.8 (octasulfur), þó að það sé óreglulegt, hefur það einnig oxunartölu 0.
 Ákveðið hvort efnið sem um ræðir sé jón. Jónar hafa oxunartölur sem eru jafnar hleðslu þeirra. Þetta á við um óbundnar jónir sem og jónir sem eru hluti af samsettri jón.
Ákveðið hvort efnið sem um ræðir sé jón. Jónar hafa oxunartölur sem eru jafnar hleðslu þeirra. Þetta á við um óbundnar jónir sem og jónir sem eru hluti af samsettri jón. - Til dæmis hefur jónin Cl oxunartölu -1.
- Cl jónin hefur enn oxunartala -1 þegar það er hluti af efnasambandinu NaCl. Þar sem Na jón, samkvæmt skilgreiningu, hefur hleðslu +1, vitum við að Cl jónin hefur hleðslu -1, þannig að oxunartala er enn -1.
 Ef um er að ræða málmajónir er gott að muna að margar oxunartölur eru mögulegar. Margir málmar geta haft fleiri en eina lendingu. Til dæmis getur málmjárnið (Fe) verið jón með hleðslu +2 eða +3. hleðslu málmajóna (og þar með oxunartölur þeirra) er hægt að ákvarða miðað við hleðslu annarra atóma í samsetningu sem þau eru hluti af, eða, þegar það er skrifað sem texti, með táknmyndinni í rómverskum tölustöfum (svo sem í setningin: „Járn (III) jónin hefur hleðslu +3.“).
Ef um er að ræða málmajónir er gott að muna að margar oxunartölur eru mögulegar. Margir málmar geta haft fleiri en eina lendingu. Til dæmis getur málmjárnið (Fe) verið jón með hleðslu +2 eða +3. hleðslu málmajóna (og þar með oxunartölur þeirra) er hægt að ákvarða miðað við hleðslu annarra atóma í samsetningu sem þau eru hluti af, eða, þegar það er skrifað sem texti, með táknmyndinni í rómverskum tölustöfum (svo sem í setningin: „Járn (III) jónin hefur hleðslu +3.“). - Skoðum til dæmis efnasamband sem inniheldur áljón. Efnasambandið AlCl3 hefur hleðsluna 0. Vegna þess að við vitum að Cl jónir hafa hleðslu -1 og 3 Cl jónir eru til staðar í efnasambandinu, verður Al-jónin að hafa hleðslu +3, þannig að hleðsla allra jóna sem bætt er saman er 0. Svo að oxunartala Al er +3.
 Gefðu súrefni (-2 með undantekningum) oxunartölu -2. Í næstum því í öllum tilfellum hafa súrefnisatóm oxunartölu -2. Það eru nokkrar undantekningar frá þessari reglu:
Gefðu súrefni (-2 með undantekningum) oxunartölu -2. Í næstum því í öllum tilfellum hafa súrefnisatóm oxunartölu -2. Það eru nokkrar undantekningar frá þessari reglu: - Þegar súrefni er í frumefni (O2), þá er oxunartala jafnt og 0, sem er raunin fyrir öll frumatóm.
- Þegar súrefni er hluti af peroxíð, þá er oxunartala -1. Peroxíð er flokkur efnasambanda sem hafa súrefnis-súrefnistengi (eða peroxíðanjón O2). Til dæmis í sameindinni H2O2 (vetnisperoxíð), súrefni hefur oxunartölu (og hleðslu) -1. Einnig þegar súrefni er hluti af súperoxíði er oxunartalið -0,5.
- Þegar súrefni er bundið við flúor er oxunartalið +2. Sjá flúorregluna hér að neðan til að fá frekari upplýsingar. Ég ekki2F.2) þetta er +1.
 Úthlutaðu oxunartölu +1 við vetni (með undantekningum). Eins og með súrefni fer oxunartala vetnis eftir undantekningartilvikum. Almennt hefur vetni oxunartölu +1 (nema í frumformi, H.2). En ef um sérstakt efnasamband er að ræða sem kallast blendingar, hefur vetni oxunartölu -1.
Úthlutaðu oxunartölu +1 við vetni (með undantekningum). Eins og með súrefni fer oxunartala vetnis eftir undantekningartilvikum. Almennt hefur vetni oxunartölu +1 (nema í frumformi, H.2). En ef um sérstakt efnasamband er að ræða sem kallast blendingar, hefur vetni oxunartölu -1. - Til dæmis frá H2Ó, við vitum að vetni hefur oxunartölu +1 vegna þess að súrefni hefur hleðslu -2 og við þurfum 2 +1 hleðslu til að búa til efnasamband með heildarhleðslu núll. En með efnið natríumhýdríð, NaH, hefur vetni oxunartölu -1 vegna þess að Na jónin hefur hleðslu +1 og, til að gera heildarhleðslu efnasambandsins 0, hefur vetni hleðslu (og þar með oxunartölu) af -1.
 Flúor alltaf oxunartala -1. Eins og fram kemur hér að ofan geta oxunartölur tiltekinna frumefna verið mismunandi vegna ýmissa þátta (málmjónir, súrefnisatóm í peroxíðum osfrv.). Flúor hefur aftur á móti oxunartölu -1 og það breytist aldrei. Þetta er vegna þess að flúor er frumefni sem er neikvæðast eða með öðrum orðum það er frumefnið sem er síst tilbúið til að láta af rafeindum og líklegast til að taka við rafeindum af öðrum atómum. Þess vegna breytist oxunarnúmerið ekki.
Flúor alltaf oxunartala -1. Eins og fram kemur hér að ofan geta oxunartölur tiltekinna frumefna verið mismunandi vegna ýmissa þátta (málmjónir, súrefnisatóm í peroxíðum osfrv.). Flúor hefur aftur á móti oxunartölu -1 og það breytist aldrei. Þetta er vegna þess að flúor er frumefni sem er neikvæðast eða með öðrum orðum það er frumefnið sem er síst tilbúið til að láta af rafeindum og líklegast til að taka við rafeindum af öðrum atómum. Þess vegna breytist oxunarnúmerið ekki.  Oxunartölur í efnasambandi eru jafnar hleðslu efnasambandsins. Oxunartölur allra atóma í efnasambandi eru jafnar hleðslu þess efnasambands. Til dæmis, ef efnasamband hefur enga hleðslu, þá verður summan af öllum oxunartölum núll; ef efnasambandið er fjölliða jón með hleðslunni -1, þá verða viðbættar oxunar tölur að vera -1 o.s.frv.
Oxunartölur í efnasambandi eru jafnar hleðslu efnasambandsins. Oxunartölur allra atóma í efnasambandi eru jafnar hleðslu þess efnasambands. Til dæmis, ef efnasamband hefur enga hleðslu, þá verður summan af öllum oxunartölum núll; ef efnasambandið er fjölliða jón með hleðslunni -1, þá verða viðbættar oxunar tölur að vera -1 o.s.frv. - Þetta er góð leið til að athuga svar þitt - ef samanlagðar oxunartölur efnasambands eru ekki jafnar hleðslu þess efnasambands, þá veistu að þú hefur gert mistök.
2. hluti af 2: Úthluta atómum tölum án reglna um oxunartölur
 Finndu atóm án oxunarnúmerareglna. Sum atóm fylgja ekki reglum um að finna oxunartölur. Ef atóm er ekki í samræmi við ofangreindar reglur og þú ert ekki viss um hver hleðsla þess er (til dæmis ef það er hluti af stærra efnasambandi þannig að einstök hleðsla sé óþekkt), getur þú fundið oxunarnúmer þess atóms með brotthvarf. Fyrst ákvarðarðu hver oxun hvers annars atóms í efnasambandinu er. Síðan leysir þú summuna fyrir hið óþekkta í jöfnunni, byggt á heildarhleðslu efnasambandsins.
Finndu atóm án oxunarnúmerareglna. Sum atóm fylgja ekki reglum um að finna oxunartölur. Ef atóm er ekki í samræmi við ofangreindar reglur og þú ert ekki viss um hver hleðsla þess er (til dæmis ef það er hluti af stærra efnasambandi þannig að einstök hleðsla sé óþekkt), getur þú fundið oxunarnúmer þess atóms með brotthvarf. Fyrst ákvarðarðu hver oxun hvers annars atóms í efnasambandinu er. Síðan leysir þú summuna fyrir hið óþekkta í jöfnunni, byggt á heildarhleðslu efnasambandsins. - Til dæmis í efnasambandinu Na2SVO4, hleðsla brennisteins (S) er óþekkt - hún er ekki í frumformi, svo hún er ekki 0, en það er það eina sem við vitum. Þetta er góður kandídat til að beita þessari aðferð til að ákvarða oxunartölu algebrulega.
 Finndu þekkt oxunartölur annarra frumefna í efnasambandinu. Með því að nota úthlutunarreglur um oxunarnúmer ákvarðum við hvaða oxunarnúmer önnur atóm í efnasambandinu hafa. Vertu meðvitaður um undantekningar eins og O, H o.s.frv.
Finndu þekkt oxunartölur annarra frumefna í efnasambandinu. Með því að nota úthlutunarreglur um oxunarnúmer ákvarðum við hvaða oxunarnúmer önnur atóm í efnasambandinu hafa. Vertu meðvitaður um undantekningar eins og O, H o.s.frv. - Í Na2SVO4, við vitum, miðað við reglur okkar, að Na jónin hefur hleðslu (og þar með oxunartölu) +1 og súrefnisatómin hafa oxunartölur -2.
 Margfaldaðu fjölda hvers atóms með oxunartölu. Nú þegar við þekkjum oxunartölur allra atóma nema hið óþekkta verðum við að huga að sum þessara atóma geta komið fyrir oftar en einu sinni. Margfaldaðu hvern stuðul (skrifaður í undirskrift á eftir tákninu í atóminu í efnasambandinu) með oxunartölu.
Margfaldaðu fjölda hvers atóms með oxunartölu. Nú þegar við þekkjum oxunartölur allra atóma nema hið óþekkta verðum við að huga að sum þessara atóma geta komið fyrir oftar en einu sinni. Margfaldaðu hvern stuðul (skrifaður í undirskrift á eftir tákninu í atóminu í efnasambandinu) með oxunartölu. - Varðandi Na2SVO4, við vitum að það eru 2 Na atóm og 4 O atóm. Nú gerum við eftirfarandi útreikning, 2 × +1, til að fá oxunartölu Na, 2 og við margföldum 4 × -2, oxunartölu O, -8.
 Bætið niðurstöðunum saman. Að bæta við niðurstöðum þessara margföldunar gefur oxunartölu efnasambandsins, án að teknu tilliti til oxunar númer óþekkta atómsins.
Bætið niðurstöðunum saman. Að bæta við niðurstöðum þessara margföldunar gefur oxunartölu efnasambandsins, án að teknu tilliti til oxunar númer óþekkta atómsins. - Í dæmi okkar með Na2SVO4, bætum við 2 við -8 til að fá -6.
 Reiknaðu óþekktu oxunarnúmerið miðað við hleðslu efnasambandsins. Þú hefur nú öll gögn til að finna óþekktu oxunarnúmerið með því að nota einfalda algebru. Við munum nota jöfnu og svarið frá fyrra skrefi, auk hleðslu efnasambandsins. Með öðrum orðum: (Summan af óþekktu oxunartölunum) + (óþekkt oxunarnúmerið sem þú vilt vita) = (hleðsla efnasambandsins).
Reiknaðu óþekktu oxunarnúmerið miðað við hleðslu efnasambandsins. Þú hefur nú öll gögn til að finna óþekktu oxunarnúmerið með því að nota einfalda algebru. Við munum nota jöfnu og svarið frá fyrra skrefi, auk hleðslu efnasambandsins. Með öðrum orðum: (Summan af óþekktu oxunartölunum) + (óþekkt oxunarnúmerið sem þú vilt vita) = (hleðsla efnasambandsins).- Í dæminu um Na2SVO4, við leysum þetta sem hér segir:
- (Summa þekktra oxunartala) + (óþekkt oxunarnúmer sem þú vilt leysa) = (hleðsla efnasambandsins)
- -6 + S = 0
- S = 0 + 6
- S = 6. S hefur oxunartölu eða 6 í Na2SVO4.
- Í dæminu um Na2SVO4, við leysum þetta sem hér segir:
Ábendingar
- Atóm í grunnformi hafa alltaf oxunartölu 0. Jón sem samanstendur af 1 atómi hefur oxunartölu jafnt hleðslunni. Hópur 1A málmar eins og vetni, litíum og natríum hafa oxunartölu +1; Hópur 2A málmar, svo sem magnesíum og kalsíum, hafa oxunartölu +2. Bæði vetni og súrefni geta haft 2 mismunandi oxunartölur, allt eftir tengingu þeirra.
- Í efnasambandi ætti summan af öllum oxunartölum að vera jöfn 0. Ef það er jón með 2 atóm, þá ætti summan af oxunartölunum að vera jöfn hleðslu jóna.
- Það er mjög gagnlegt að vita hvernig á að lesa reglulegu töflu og hvar á að finna málma og ekki málma.
Nauðsynjar
- Regluborð yfir frumefnin
- Netsamband
- Efnafræðibók
- Pappír, penni eða blýant
- Reiknivél