Höfundur:
Randy Alexander
Sköpunardag:
1 April. 2021
Uppfærsludagsetning:
1 Júlí 2024
Efni.
Í efnafræði, gildisrafeindir eru rafeindir staðsettar í ysta lagi rafeindaskeljar frumefnis. Að ákvarða fjölda gildisrafeinda frumefnis er mikilvæg tækni í efnafræði vegna þess að þessar upplýsingar munu hjálpa til við að ákvarða tegundir skuldabréfa sem frumefni geta myndað. Það er auðvelt að ákvarða fjölda gildisrafeinda með reglulegu töflu efnaþátta.
Skref
Hluti 1 af 2: Finndu fjölda gildisrafeinda með reglulegu töflu
Með málmi sem ekki er að umbreytast
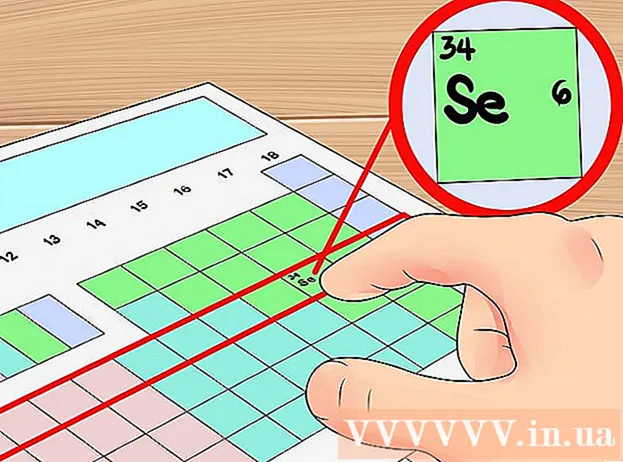
Hafðu einn tilbúinn Lotukerfið efnaþætti. Regluborð frumefna (skammstafað reglulega taflan) er litakóðuð fjölfrumutafla sem sýnir alla þekkta þætti sem og nokkrar nauðsynlegar upplýsingar um þessir þættir. Út frá fyrirliggjandi upplýsingum í reglubundnu töflu getum við ákvarðað fjölda gildisrafeinda frumefnisins sem við erum að rannsaka. Regluborð er venjulega fest við kennslubók. Þú getur einnig vísað í þessa gagnvirku reglulegu töflu.

Talið hvern dálk í reglulegu töflu frá 1 til 18. Venjulega í lotukerfinu munu allir þættir í sama dálki hafa sama fjölda rafeinda. Ef lotuborðið þitt hefur ekki númerað dálka enn, gerðu það sjálfur með því að númera 1 til 18 lóðrétt frá vinstri til hægri. Vísindalega er hver dálkur í lotukerfinu kallaður einn „hópur“.- Til dæmis, fyrir óundirritað lotukerfi, myndum við tala 1 fyrir ofan frumefnið Vetni (H), tala 2 fyrir ofan frumefnið Beri (Be) og gera það sama þar til 18 fyrir ofan Helium (He ).

Ákveðið stöðu viðkomandi frumefnis. Í þessu skrefi skaltu ákvarða stöðu frumefnisins sem þú ert að skoða á periodic borðinu. Þú getur fundið stöðu frumefnis út frá efnatákninu (bókstafur í hverri frumu), lotu númeri (númerið efst í vinstra horni hverrar frumu) eða byggt á upplýsingum skilaboð eru í boði í reglulegu töflu.- Til dæmis þurfum við að finna fjölda gildisrafeinda frumefnisins Kolefni (C). Atómtala frumefnisins er 6. Kolefnið er í efri hluta frumefna hópsins 14. Í næsta skrefi munum við ákvarða fjölda gildisrafeinda þessa frumefnis.
- Í þessum kafla munum við hunsa umbreytingarmálma, þ.e frumefni á bilinu hópa 3 til 12. Þessir umskiptingsmálmar eru aðeins frábrugðnir hinum, svo skrefin eru Það sem nefnt er í þessum kafla á ekki við um slíka málma. Við munum skoða þessa þætti hópa síðar í greininni.

Notaðu hópnúmerið til að ákvarða fjölda gildisrafeinda. Hópnúmerið frá málmi sem ekki er umbreyting er hægt að nota til að reikna fjölda gildisrafeinda í atómi þess frumefnis. „Einingaröð hópsnúmersins“ er fjöldi gildisrafeinda sem eru til staðar í atómum frumefna þess hóps. Með öðrum orðum:- Hópur 1: 1 gildi rafeind
- Hópur 2: 2 gildisrafeindir
- Hópur 13: 3 gildisrafeindir
- Hópur 14: 4 gildisrafeindir
- Hópur 15: 5 gildisrafeindir
- Hópur 16: 6 gildisrafeindir
- Hópur 17: 7 gildisrafeindir
- Hópur 18: 8 gildisrafeindir (nema helíum með 2 gildisrafeindir)
- Í kolefnisdæminu, þar sem kolefnið er í hópi 14, gætum við sagt að kolefnisatóm hafi fjórar gildisrafeindir.
Með umskipti málmi
Þekkja þætti á bilinu frá hópi 3 upp í hóp 12. Eins og getið er hér að ofan eru frumefnin í hópum 3 til 12 kölluð „umskiptingsmálmar“ og þegar kemur að gildisrafeindir hafa þeir aðra eiginleika en restin. Í þessum kafla munum við læra hvers vegna það er oft ekki mögulegt að úthluta gildisrafeindum til atóm umskiptimálmanna.
- Í þessum kafla tökum við frumefnið Tantan (Ta) sem er atómtala 73 sem dæmi. Næstu skref hjálpa til við að ákvarða fjölda rafeinda frumefnisins.
- Athugið að frumefni þriggja fjölskyldulantana og actiniumsins (einnig þekkt sem „sjaldgæfu jarðmálmarnir“) tilheyra einnig hópi umskiptimálma - þessir tveir frumefnahópar eru venjulega taldir fyrir neðan reglubundna töflu. höfuð með lantan og actini.
Gildisrafeindir í umskiptimálmum eru ekki það sama og „venjulegar“ gildisrafeindir. Til að skilja hvers vegna umskiptimálmar „virka“ ekki eins og aðrir þættir í reglulegu töflu, verðum við að vita svolítið um hvernig rafeindir vinna í atóminu eins og útskýrt er hér að neðan. , eða þú getur sleppt þessu skrefi.
- Þegar rafeindum er stungið í atóm er þeim raðað í mismunandi „svigrúm“ - mismunandi svæði í kringum kjarnann. Í stuttu máli sagt, gildisrafeindir eru rafeindirnar staðsettar í ysta sporbraut - með öðrum orðum síðustu rafeindirnar sem bætt var við atómið.
- Að útskýra svigrúmið í smáatriðum er kannski svolítið flókið, þegar rafeindum er bætt við undirflokkinn d af lotukerfinu af umbreytingarmálminum (sjá hér að neðan) mun fyrsta þessara rafeinda hegða sér eins og venjulegar gildisrafeindir, en þá geta eiginleikar þeirra breyst, tvöfalt þegar rafeindir frá öðrum svigrúm geta virkað sem gildisrafeindir. Það er, atóm getur haft margar gildisrafeindir eftir atvikum.
- Þú getur lært meira um þetta á Clackamas Community College gildi rafeindasíðu.
Finndu fjölda gildisrafeinda út frá hópnúmerinu. Eins og fram hefur komið hér að ofan fyrir málma sem ekki eru umskipti, getur hópnúmerið í lotuborðinu hjálpað til við að ákvarða fjölda gildisrafeinda. Hins vegar er engin ákveðin formúla til að ákvarða nákvæman fjölda gildisrafeinda rásarmálmsins - í þessu tilfelli er fjöldi gildisrafeinda frumefnis ekki á föstu gildi, fjöldi hlutanna. sjálfshópar geta aðeins sagt hlutfallslegan fjölda gildisrafeinda. Smáatriði:
- Hópur 3: 3 gildisrafeindir
- Hópar með 4: 2 til 4 gildisrafeindir
- Hópur 5: 2 til 5 gildisrafeindir
- Hópur 6: 2 til 6 gildisrafeindir
- Hópar 7: 2 til 7 gildisrafeindir
- Hópar 8: 2 til 3 gildisrafeindir
- Hópar 9: 2 til 3 gildisrafeindir
- Hópar 10: 2 til 3 gildisrafeindir
- Hópar 11: 1 til 2 gildisrafeindir
- Hópur 12: 2 gildisrafeindir
- Ef við tökum dæmi um frumefnið Tanta (Ta) úr hópi 5 getum við sagt að þetta frumefni hafi frá 2 til 5 gildisrafeindir, eftir atvikum.
2. hluti af 2: Finndu fjölda gildisrafeindir byggðar á stillingum rafeinda
Lærðu hvernig á að lesa rafeindastilling. Byggt á rafeindastillingu frumefnis getum við einnig ákvarðað fjölda gildisrafeinda þess frumefnis. Rafstillingar líta flókið út, en það er bara hvernig á að tákna svigrúm frumefnis í formi bókstafa og tölustafa, þegar þú hefur fattað lögin, er skilningur á rafeindastilling ekki erfitt.
- Lítum á dæmi um rafeindastilling natríums (Na):
- 1s2s2p3s
- Ef þú gefur gaum muntu sjá að rafeindastillingin er bara strengur endurtekninga:
- (tala) (orð) (tala) (orð) ...
- ... og svo framvegis. Hópur (tala) (orð) það fyrsta er nafn svigrúmsins og táknar fjölda rafeinda í þeim svigrúmi.
- Svo í okkar tilfelli getum við sagt að natríum geri það 2 rafeindir á 1s svigrúminu, 2 rafeindir í 2s brautinni, 6 rafeindir í 2p svigrúminu og 1 rafeind í 3 3ja svigrúm. Alls eru 11 rafeindir - atómtala natríums er einnig 11.
- Lítum á dæmi um rafeindastilling natríums (Na):
Finndu rafeindastilling frumefnisins sem þú ert að skoða. Þegar þú veist að rafeindastilling frumefnis er að finna rafeindastilling þess frumefnis er ekki erfitt (nema þegar um er að ræða málma umskipti). Ef rafeindastillingin er fáanleg í spurningunni sem þú þarft að leysa geturðu sleppt þessu skrefi. Ef þú þarft að finna rafeindastillinguna skaltu halda áfram með eftirfarandi skrefum:
- Heild rafeindastilling frumefnisins ununocti (Uuo), atómtala 118 er:
- 1s2s2p3s3p4s3d4p5s4d5p6s4f5d6p7s5f6d7p
- Þegar þú hefur fengið svo fullkomna rafeindastillingu, til að finna rafeindastilling annars frumefnis, þarftu bara að fylla svigrúm með rafeindum, frá og með fyrsta hringbraut þangað til fjöldi rafeinda hefur runnið út til að fylla. Það hljómar flókið en þegar kemur að því er það tiltölulega auðvelt. Til dæmis, ef við vildum skrifa alla rafeindastilling klórs (Cl), frumefnis 17, það er atóms þessa frumefnis hefur 17 rafeindir, myndum við fylla út eftirfarandi:
- 1s2s2p3s3p
- Athugaðu að heildar fjöldi rafeinda í rafeindastillingum passar bara rétt 17: 2 + 2 + 6 + 2 + 5 = 17. Þú þarft bara að breyta tölunni á síðasta braut - restin er sú sama því næst næstsíðasta brautin er full rafeind.
- Lærðu meira um hvernig á að skrifa rafeindastillingu frumefnis.
- Heild rafeindastilling frumefnisins ununocti (Uuo), atómtala 118 er:

Úthluta rafeindum til svigrúm samkvæmt áttundu reglu. Þegar rafeindum er bætt við frumeind er þeim raðað í svigrúm í röðinni sem að framan greinir - fyrstu tvær rafeindirnar verða settar í 1s svigrúm, næstu tvær rafeindir í 2s svigrúm, næstu sex rafeindir eru settar í svigrúm 2p, gerðu það þar til rafeindin er sett í samsvarandi braut. Þegar við hugleiðum frumeindir frumefna sem ekki eru umbreytingar, getum við sagt að þessi svigrúm muni mynda „lög“ í kringum kjarnann, þar sem eftirfarandi lag verður lengra frá kjarnanum en það sem var á undan honum. Til viðbótar við fyrsta svigrúm sem getur aðeins geymt allt að tvær rafeindir, geta öll svigrúm til að taka allt að átta rafeindir (nema þegar um er að ræða málma umskipti). Þessi regla er kölluð Áttfalda reglan.- Lítum til dæmis á frumefnið Bo (B). Atómtala þessa frumefnis er 5, þannig að við höfum rafeindastilling þessa frumefnis sem hér segir: 1s2s2p. Þar sem fyrsta svigrúmsskelin inniheldur aðeins 2 rafeindir er mögulegt að ákvarða að Bo hefur tvö svigrúm: sú fyrsta samanstendur af 2 rafeindum á 1s svigrúminu og sú seinni með þremur rafeindum sem dreifast á 2s og 2p svigrúminu. .
- Til að fá annað dæmi, þá ætti frumefni svipað og klór að hafa þrjú lög: lag af tveimur rafeindum í 1s svigrúminu, lag af tveimur rafeindum í 2s svigrúminu og sex rafeindum í 2p svigrúminu og ytra lagi af tveimur rafeindum í 3 svigrúminu. og fimm rafeindir á 3p svigrúm.

Finndu fjölda rafeinda í ysta laginu. Þegar rafeindastillingin hefur verið ákvörðuð, vitum við nú þegar lög þess frumefnis, að finna fjölda gildisrafeinda er hægt að gera með því að ákvarða fjölda rafeinda í ysta lagi atómrafeindarskelarinnar. Ef ysta lagið er fullt (þ.e. þegar með samtals átta rafeindir, eða í fyrsta lagi 2 rafeindir) þá er það frumefni kallað óvirkt frumefni og tekur varla þátt í efnahvörfum. Þessi regla á þó ekki við umskipti málma.- Til dæmis með frumefnið Bo, þar sem Bo hefur þrjár rafeindir í öðru laginu, einnig ysta lagið, getum við sagt að frumefnið Bo hafi faðir gildisrafeindir.

Notaðu raðnúmerið í reglulegu töflu sem styttri leið til að ákvarða fjölda svigrúm. Lárétt röðin á reglulegu töflu kallast „hringrás“ frumefnanna. Frá fyrstu röðinni samsvarar hver hringrás 'fjölda rafeindalaga' frumefnanna á sama tímabili. Þess vegna geturðu notað tímabilið til að ákvarða fljótt fjölda gildisrafeinda frumefnis - þú telur bara fjölda rafeinda í röð frá vinstri til hægri frá fyrsta frumefni þess tímabils. Athugaðu enn og aftur að þetta á ekki við umskipti málma.- Til dæmis, þar sem selen tilheyrir hringrás 4, má ákvarða að frumefnið hafi fjögur rafeindalög í lotukerfinu. Þar sem þetta er sjötta frumefnið í hringrás 4 (að undanskildum umskiptismálminum), frá röð til vinstri til hægri, getum við sagt að fjórða skel selens hafi sex rafeindir, þ.e.a.s. sex gildisrafeindir.
Ráð
- Athugið að rafeindastillingin er hægt að skrifa stuttlega með sjaldgæfum lofttegundum (frumefni í hópi 18) í stað svigrúm efst í stillingunni. Til dæmis gæti rafeindastilling natríums verið skrifuð sem 3s1 - það er, rafeindastilling natríums er sú sama og Neon en það er auka rafeind í 3s svigrúminu.
- Umbreytingarmálmar geta haft ófullkomna gildisundirflokka. Til þess að ákvarða nákvæmlega gildistölu umskiptismálmsins er nauðsynlegt að nota flóknar skammtafræðilegar meginreglur sem ekki falla undir þessa grein.
- Það er einnig mikilvægt að hafa í huga að reglulegt tafla yfir efnaþætti getur verið mismunandi í mismunandi löndum. Svo skaltu ganga úr skugga um að þú notir sameiginlegu reglulegu töflu þar sem þú býrð til að koma í veg fyrir rugling.
Það sem þú þarft
- Periodic table of chemical frumefni
- Blýantur
- Pappír